STR分型是目前法医遗传学中的核心分型技术[1],常染色体STR分型在个体识别和亲子关系鉴定方面发挥着重要作用,Y染色体STR(Y-STR)主要应用于父系亲缘鉴定。在一些重特大刑事案件侦察过程中,往往对现场提取的物证先进行常染色体STR检测,确认犯罪嫌疑人为男性时,加做Y-STR检测以获得更多遗传信息,为案件办理增加侦查线索。这种常规的检测程序一方面检测时间较长可能会延误抓获犯罪嫌疑人的最佳时机,另一方面犯罪嫌疑人遗留在现场物证量微,多次检测可能增加检测失败的概率[2-5]。为了克服这些局限性,本研究拟开发19个常染色体、30个Y-STR基因座以及性别基因座的六色荧光检测试剂盒(简称EX20+30Y试剂盒),将原来的2次检测变为1次检测,即可获得用于身份认定的常染色体STR基因座信息,也可获得用于家系排查的Y-STR基因座信息。
1 材料与方法
1.1 样本
血卡样本以及案件样本来源于上饶公安司法鉴定中心,包括:法庭科学DNA数据库中的无关个体血样210份;日常检案样品69份,其中血斑23份、唾液斑17份、烟蒂19份、指纹接触擦拭物4份、精斑6份。标准品9948(男性)、标准品9947A(女性)来自无锡中德美联生物技术有限公司,将标准品用双蒸水分别稀释至1.0、0.5、0.25、0.125、0.062 5 ng/μL;黑猩猩(广州市刑事科学技术研究所提供),猫、狗、猪、牛、羊、鸡血液样品(上海生物制品研究所提供),大肠杆菌(无锡中德美联生物技术有限公司提供)通过磁珠法提取得到样品DNA。
1.2 主要仪器与试剂
3730xl基因分析仪、3500xL基因分析仪、9700型PCR仪(美国Applied Biosystems公司),BSD600-DUET打孔仪(澳大利亚BSD Robotics公司),Goldeneye® DNA身份鉴定系统20A[基点认知技术(北京)有限公司],YfilerTM Plus PCR扩增试剂盒(美国Thermo Fisher Scientific公司)。引物由生工生物工程(上海)股份有限公司合成,反应缓冲液[含2.5 mmol/L Mg2+、0.25 mmol/L dNTP、50 mmol/L Tris盐酸盐,pH值8.3、50 mmol/L KCl、10 mmol/L甜菜碱,1.2 mmol/L 牛血清白蛋白(bovine serum albumin,BSA)封闭液和6%甘油]、热启动C-Taq酶及内标AGCU Marker SIZ-700均来自无锡中德美联生物技术有限公司。样品载体包括血样采集卡(加强型)、血样采集卡(经典型)、血样采集卡(迷你型)(长春市博坤生物科技有限公司),Whatman FTA标准卡、903卡(英国Whatman公司),DNA血样采集卡(北京达博创新科技开发有限公司),普通滤纸型血卡。去离子甲酰胺(美国Applied Biosystems公司)。
1.3 复合扩增体系的建立
1.3.1 基因座的选择
选择目前应用最为广泛的Goldeneye® DNA身份鉴定系统20A全部19个常染色体STR基因座加性别基因座、YfilerTMPlus PCR扩增试剂盒全部27个Y-STR基因座、DYS596及DYS527a/b,共30个Y-STR基因座(表1)。
表1 EX20+30Y试剂盒中19个常染色体和30个Y-STR基因座位点信息 (Continued Tab. 1)
Tab. 1
| 基因座 | 等位基因范围 | 荧光 标记1) | 核心重复模式 | 染色体位置 | GenBank 登录号2) | 引物体系浓度/(μmol·L-1) |
|---|---|---|---|---|---|---|
| DYS391 | 6~13 | 6-FAM | [TCTA] | Yq11.21 | AC011302:11 | 0.343 |
| D3S1358 | 11~20 | 6-FAM | [AGAT] | 3p21.31 | AC099539 | 0.093 |
| D13S317 | 6~15 | 6-FAM | [GATA] | 13q22~31.1 | AL353628.2 | 0.076 |
| D7S820 | 6~15 | 6-FAM | [GATA] | 7q11.21~21.11 | AC004848 | 0.102 |
| D16S539 | 5~15 | 6-FAM | [GATA] | 16q24.1 | AC024591.3 | 0.236 |
| Penta E | 5~25 | 6-FAM | [AAAGA] | 15q26.2 | AC027004 | 0.500 |
| DYS635 | 17~27 | 6-FAM | [TCTA] [TGTA] | Yq11.21 | AC004772:23 | 0.480 |
| DYS385a/b | 9~28 | 6-FAM | [GAAA] | Yq11.222 | AC022486:11 | 0.124 |
| DYF387S1a/b | 29~45 | 6-FAM | [AAAG] [GTAG] [GAAG] [AAAG] [GAAG] [AAAG] [GAAG] [AAAG] | Yq11.223/Yq11.23 | AC025246 | 0.165 |
| DYS456 | 13~19 | HEX | [AGAT] | Yp11.2 | AC010106:15 | 0.166 |
| TPOX | 6~14 | HEX | [AATG] | 2p25.3 | M68651 | 0.345 |
| TH01 | 4~13.3 | HEX | [AATG] | 11p15.5 | D00269 | 0.528 |
| D2S1338 | 14~27 | HEX | [TGCC] [TTCC] | 2q35 | AC010136 | 0.400 |
| D6S1043 | 9~21.3 | HEX | [AGAT] | 6q15 | G08539:11 | 0.194 |
| FGA | 15~50.2 | HEX | [TTTC]3TTTTTTCT [CTTT]CTCC[TTCC]2 | 4q28 | M64982 | 0.159 |
| DYS438 | 7~14 | HEX | [TTTTC] | Yq11.21 | AC002531:10 | 0.235 |
| DYS448 | 15~23 | HEX | [AGAGAT] | Yq11.223 | AC025227:22 | 0.165 |
| DYS570 | 9~27 | HEX | [GATA] | Yp11.2 | AC012068 | 0.126 |
| DYS437 | 12~17 | SUM | [TCTA] | Yq11.21 | AC002992 | 0.107 |
| D19S433 | 9~17.2 | SUM | [AAGG] [AAAG] [AAGG] [TAGG] [AAGG] | 19q12 | AC008507.6 | 0.255 |
| vWA | 12~22 | SUM | [AGAT] | 12p13.31 | M25858 | 0.380 |
| DYS19 | 12~19 | SUM | [TAGA] | Yp11.2 | AC017019:15 | 0.066 |
| CSF1PO | 7~15 | SUM | [AGAT] | 5q33.1 | X14720 | 0.040 |
| D18S51 | 9~28 | SUM | [GAAA] | 18q21.33 | AP001534 | 0.080 |
| DYS627 | 10~28 | SUM | [AGAA]N16[AGAG] [AAAG]N81[AAGG] | Yp11.2 | AC009491 | 0.200 |
| DYS576 | 12~23 | SUM | [AAAG] | Yp11.2 | AC010104 | 0.100 |
| DYS449 | 21~39 | SUM | [TTTC] | Yp11.2 | AC051663 | 0.240 |
| DYS460 | 5~14 | LYN | ATCT | Yq11.222 | AC009235 | 0.050 |
| D8S1179 | 8~19 | LYN | [TATC] | 8q24.13 | AF216671 | 0.200 |
| D5S818 | 7~15 | LYN | [AGAT] | 5q21-31 | AC008512 | 0.267 |
| D21S11 | 25~37 | LYN | [TCTA] [TCTG] | 21q11.2-q21 | AP000433 | 0.170 |
| D12S391 | 15~28 | LYN | [AGAT]8~17[AGAC]6~10[AGAT]0~1 | Chr12; 12.341 Mb | AF0769651 | 0.290 |
| Penta D | 2.2,5~17 | LYN | [AAAGA] | 21q22.3 | AP001752 | 0.180 |
| DYS458 | 12~23 | LYN | [GAAA] | Yp11.2 | AC010902:16 | 0.135 |
| DYS533 | 7~15 | LYN | [ATCT] | Yq11.221 | AC053516 | 0.321 |
| DYS518 | 30~49.2 | LYN | [AAAG] [GAAG] [AAAG] [GGAG] [AAAG] | Yq11.221 | AC010972 | 0.360 |
| Amelogenin | X,Y | PUR | - | X:p22.1-22.3 Y:p11.2 | NG_012040.1 | 0.119 |
| DYS393 | 9~16 | PUR | [AGAT] | Yp11.2 | AC006152:12 | 0.166 |
| DYS389Ⅰ | 11~16 | PUR | [TCTG] [TCTA] | Yq11.21 | AC004617:12 | 0.180 |
| DYS439 | 7~15 | PUR | [AGAT] | Yq11.21 | AC002992:13 | 0.190 |
| DYS389Ⅱ | 25~33 | PUR | [TCTG] [TCTA] [TCTG] [TCTA] | Yq11.21 | AC004617:29 | 0.263 |
| DYS392 | 7~17 | PUR | [TAT] | Yq11.223 | AC011745:13 | 0.198 |
| Y-GATA-H4 | 7~15 | PUR | [TAGA] | Yq11.1 | AC011751:12 | 0.216 |
| DYS390 | 19~27 | PUR | [TCTA] [TCTG] | Yq11.221 | AC011289:24 | 0.160 |
| DYS481 | 16~32 | PUR | [CTT] | Yp11.2 | AC016991.5:22 | 0.143 |
| DYS596 | 12~18 | PUR | [GGA] [GTA] [GGA] [GAA] [GGAGAA] | Yp11.2 | AC016991 | 0.384 |
| DYS527a/b | 16~29 | PUR | [GGAA] | Yq11.223 | AC016752 | 0.270 |
1.3.2 引物的设计与合成
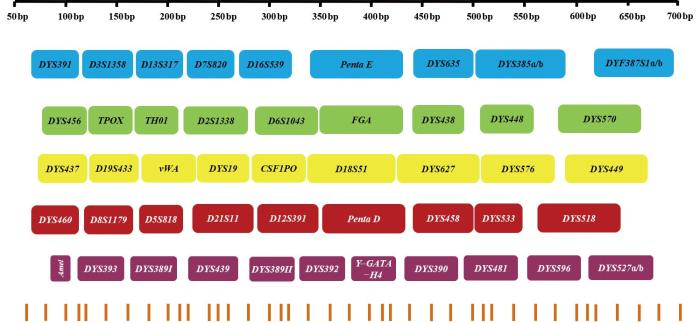
图1
图1
EX20+30Y试剂盒基因座位置分布
蓝色表示6-FAM标记,绿色表示HEX标记,黄色表示SUM标记,红色表示LYN标记,紫色表示PUR标记,橙色竖条表示内标。
Fig. 1
Loci distribution in EX20+30Y Kit
1.3.3 复合扩增体系的建立与优化
为保证复合扩增体系的效能与特异性,引物体系以单位点扩增、单色通道复合、全部引物混合扩增为原则,反复验证测试,最终确定引物复合扩增体系。根据表1引物浓度组配复合扩增引物体系。
25 μL体系:10 μL反应缓冲液,1 μL 5 U/μL 热启动C-Taq酶,5 μL 5×引物复合物,0.5~2 ng样本DNA,用双蒸水补足至25 μL。
使用9700型PCR仪进行扩增,热循环条件:95 ℃ 2 min;94 ℃ 30 s,60 ℃ 1 min,72 ℃ 1 min,15个循环;90 ℃ 30 s,58 ℃ 1 min,65 ℃ 1 min,15个循环;60 ℃ 20 min。
1.3.4 STR分型
扩增产物经3500xL型基因分析仪电泳,得到STR基因座的等位基因型。电泳条件:取1 μL PCR产物或等位基因阶梯与0.5 μL AGCU Marker SIZ-700和12 μL去离子甲酰胺混合,95 ℃变性3 min后,冰浴3 min,电泳检测,使用GeneMapper®ID v3.2软件(美国Thermo Fisher Scientific公司)进行基因分型。
1.4 复合扩增体系的性能及应用评价
1.4.1 灵敏度检测
取标准品9948,每25 μL扩增体系分别以1.0、0.5、0.25、0.125、0.062 5 ng的模板量,进行PCR扩增和DNA分型检测,每种浓度进行3次平行实验。
1.4.2 混合样本检测
取标准品9948和标准品9947A,模板总量为1 ng,分别按1∶1、1∶4、1∶9、1∶19的体积比混合,进行 PCR扩增和STR分型检测,每种混合比进行3次平行实验。
1.4.3 种属特异性检测
分别取1 μL 0.5 ng/μL人、黑猩猩DNA样本,10 ng/μL猫、狗、猪、牛、养、鸡DNA样本和10 ng大肠杆菌进行物种特异性研究,每种样本进行3次平行实验,根据试剂盒Ladder进行分析研究,按仪器使用手册上设置cutoff阈值175 RFU。
1.4.4 不同直接扩增检材适用性检测
对于同一个体的血液,采用不同类型的血卡[血样采集卡(加强型)、血样采集卡(经典型)、血样采集卡(迷你型)、Whatman FTA标准卡、903卡、DNA血样采集卡、普通滤纸型血卡]保存,通过试剂盒直接扩增后进行适用性测试。
1.4.5 案件生物检材适用性检测
日常检案样本69份,采用磁珠法提取,采用EX20+30Y试剂盒、Goldeneye® DNA身份鉴定系统20A、YfilerTM Plus PCR扩增试剂盒进行PCR扩增和STR分型。
1.4.6 抗抑制剂能力测试
采用常见抑制剂血红素、血红蛋白、腐殖酸、靛蓝、钙离子(Ca2+)和乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)进行抗抑制剂能力测试。均以0.5 ng标准品9948为模板进行扩增,抑制剂浓度分别为:血红素20、50、80、100和150 μmol/L;血红蛋白50、80、100、150和200 μmol/L;腐殖酸20、50、80、100和150 ng/μL;靛蓝4、5、8、10和12 mmol/L;Ca2+ 0.1、0.2、0.5、0.7和1.0 mmol/L;EDTA 0.1、0.5、0.8、1.0和1.2 mmol/L。
1.4.7 重复性测试
对相同DNA样本分别在Applied BiosystemsTM 3730xl基因分析仪和3500xL基因分析仪中进行分型检测。扩增采用25 μL体系,每组分别扩增10个标准品9947A、标准品9948。
2 结果
2.1 灵敏度
标准品9948以1.0、0.5、0.25、0.125、0.062 5 ng为模板量进行扩增,结果显示,当DNA模板量大于或等于0.125 ng时,3次重复实验中DNA图谱分型完整,分型结果准确清晰,均未有DNA位点丢失的情况发生;当模板量为0.062 5 ng时,3次重复实验均未获得完整分型,存在DYS533、DYF387S1a/b、DYS449等基因座丢失的情况。
2.2 混合样本检测结果
表2显示,V9948∶V9947A在1∶1和1∶4混合的情况下,标准品9948的Y-STR基因座全部检出。随着混合样本中标准品9947A模板含量的提高,当V9948∶V9947A为1∶9时,标准品9948含量为0.1 ng,低于检测限0.125 ng,Y-STR基因座检出数为27个(共30个),其中第1次5个Y-STR基因座未读出,分别为DYS533、DYF387S1a/b、DYS481及DYS518;第2次,基因座DYS533丢失;第3次,DYS533、DYF387S1a/b 3个基因座丢失。当V9948∶V9947A为1∶19时,存在多个Y-STR位点的丢失情况,基因座检出数为19个(共30个)。
表2 不同比例的混合样本中Y-STR峰型检出数
Tab. 2
| V9948∶V9947A | 标准品9948质量/pg | 标准品9947A质量/pg | 3次测量平均值/( |
|---|---|---|---|
| 1∶1 | 500 | 500 | 30±0 |
| 1∶4 | 200 | 800 | 30±0 |
| 1∶9 | 100 | 900 | 27±2 |
| 1∶19 | 50 | 950 | 19±2 |
2.3 种属特异性
在灵长类动物(黑猩猩)的DNA分型图谱中,观察到一些在100~400 bp的小峰,这些小峰可通过ladder校准后off-ladder读数与人类基因组DNA图谱区分开来。其他常见动物和微生物菌落在10 ng DNA作为起始样本扩增下均未出现有效峰型结果。
2.4 不同直接扩增检材适用性
在210份无关个体血样中直接扩增时全部检测成功,且图谱分型完整,均衡性较好,其检测成功率100%(图2)。
图2
从210例血卡中,选择同一个体不同类型的血卡[血样采集卡(加强型)、血样采集卡(经典型)、血样采集卡(迷你型)、Whatman FTA标准卡、903卡、DNA血样采集卡、普通滤纸型血卡]保存,检测结果显示,在不同类型的血卡载体中分型结果均一致。
2.5 案件生物检材适用性
69份不同类型案件检材用磁珠法提取检测,STR分型图谱清晰完整,与Goldeneye® DNA身份鉴定系统20A和YfilerTM Plus PCR扩增试剂盒中相对应基因座的DNA分型结果完全一致。
2.6 试剂盒抗抑制剂能力测试
试剂盒抗抑制剂能力测试结果如表3所示。从表3中可以看出,在血红素浓度为20、50 μmol/L,血红蛋白浓度为50和80 μmol/L,腐殖酸质量浓度为20 ng/μL,靛蓝浓度为4、5、8和10 mmol/L,Ca2+浓度为0.1、0.2、0.5和0.7 mmol/L,EDTA浓度0.5、0.8、1.0和1.2 mmol/L时,均得到100%峰型读出率。当血红素浓度增加到80 μmol/L时,DYS635、DYS19、DYS392等11个基因座未读出。血红蛋白增加到100 μmol/L时,DYS19、DYS392、DYS635基因座丢失;当浓度进一步增加到200 μmol/L时,50个基因座全部丢失。当腐殖酸质量浓度增加到50 ng/μL时,DYS596、DYS635、DYS19、DYS392、DYS533、Y-GATA-H4、DYS390及DYF387S1a/b共9个基因座均丢失。Ca2+浓度增加到1.0 mmol/L以及EDTA浓度增加到1.2 mmol/L时,DYS19、DYS392、DYS533位点也均丢失。
表3 添加不同浓度抑制剂下的基因座检出率
Tab. 3
| 抑制剂 | 浓度/ (μmol·L-1) | 检出率/ % | 抑制剂 | 浓度/ (μmol·L-1) | 检出率/ % | 抑制剂 | 浓度/ (μmol·L-1) | 检出率/ % |
|---|---|---|---|---|---|---|---|---|
| 血红素 | 20 | 100 | 腐殖酸 | 20 | 100 | Ca2+ | 0.1 | 100 |
| 50 | 100 | 50 | 82 | 0.2 | 100 | |||
| 80 | 78 | 80 | 36 | 0.5 | 100 | |||
| 100 | 38 | 100 | 28 | 0.7 | 100 | |||
| 150 | 0 | 150 | 0 | 1 | 94 | |||
| 血红蛋白 | 50 | 100 | 靛蓝 | 4 | 100 | EDTA | 0.5 | 100 |
| 80 | 100 | 5 | 100 | 0.8 | 100 | |||
| 100 | 94 | 8 | 100 | 1 | 100 | |||
| 150 | 46 | 10 | 100 | 1.2 | 100 | |||
| 200 | 0 | 12 | 94 | 1.5 | 84 |
2.7 试剂盒重复性测试
图3
图3
采用3500xL基因分析仪和EX20+30Y试剂盒检测标准品9948的电泳图谱
Fig. 3
Electrophoretogram of standard sample 9948 tested by 3500xL Gene Analyzer and EX20+30Y Kit
图4
图4
采用3730xl基因分析仪和EX20+30Y试剂盒检测标准品9948的电泳图谱
Fig. 4
Electrophoretogram of standard sample 9948 tested by 3730xl Gene Analyzer and EX20+30Y Kit
3 讨论
EX20+30Y试剂盒可联合分析常染色体基因座和Y染色体基因座的STR位点,一次性获得19个常染色体与30个Y染色体以及性别基因的遗传信息,是目前国内外采用六色荧光标记复合扩增技术中,所含基因座数量最多的常染色体与Y-STR联合检测方法[7-10]。本试剂盒还采用直接扩增技术,能有效缩短整个检测过程时间,提高整体系统效能。此外,对血痕样本及各类案件检材均具有很好的适应性,灵敏度达到0.125 ng。在种属特异性方面,不同来源的人体生物检材,包括血斑、唾液斑、精斑等,均可获得可信的基因分型图谱;对非人体DNA,包括狗、猪、牛、羊、猫、鸡及大肠杆菌DNA,在分型范围内均不出现特异的DNA分型,表明该检测体系种属特异性高。
综上所述,本研究建立的EX20+30Y试剂盒,其稳定性、准确性、灵敏度和样品适用性以及抗抑制性均达到了商品化试剂盒的检测水平,为法庭科学实践提供了一种更快速和便捷的方法,在刑案侦破以及亲权鉴定方面均具有潜在应用价值。
参考文献