多囊肾病肾移植术后死亡法医学鉴定1例
张孟周 , 1 , 2 , 贾宇晴 3 , 于天水 1 , 2 , 侯伟良 1 , 2 , 鄂晓霏 1 , 2 , 刘冉 1 , 2 , 张海东 , 1 , 2
1.司法文明协同创新中心,北京 100088
2.中国政法大学 证据科学教育部重点实验室,北京 100192
3.哈尔滨大工司法鉴定科学技术研究所,黑龙江 哈尔滨 150000
通讯作者: 张海东,男,硕士,主任法医师,副教授,硕士研究生导师,主要从事法医病理学教学、科研和鉴定;E-mail:hai-dongzh@cupl.edu.cn
编委: 张建华
收稿日期: 2020-12-21
基金资助:
中国政法大学青年教师计划资助项目 . 10820710
关键词:
法医病理学 多囊肾病 肾移植 慢性肾衰竭 尿毒症心肌病
1 案 例
1.1 简要案情
某男,43岁,2009年被诊断为“慢性肾功能不全、高血压病”,行血液透析及口服药物治疗。2015年5月行同种异体肾移植术,术后不久即出现排斥反应,血清肌酐超过300 μmol/L(正常参考值62~106 μmol/L)。经多次复诊并调整抗排异治疗方案,效果欠佳,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少。2018年3月14日—4月2日于某医院行常规检查示:血尿素氮由58.0 mmol/L逐渐上升至99.3 mmol/L(正常参考值1.8~7.3 mmol/L),血清肌酐由844.4 μmol/L逐渐上升至1 782.4 μmol/L,血红蛋白由61 g/L逐渐下降至37 g/L(正常参考值131~172 g/L)。因经济原因,未行系统性治疗。2018年4月6日,患者突发呼吸骤停、意识丧失,实验室检查结果显示:血尿素氮112.3 mmol/L,血清肌酐2 455.0 μmol/L,血红蛋白33 g/L,氨基末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)>45 000 pg/mL(正常参考值<300 pg/mL),血糖2.5 mmol/L(正常参考值3.9~6.1 mmol/L),K+ 浓度6.4 mmol/L(正常参考值3.5~5.5 mmol/L)。经积极抢救无效宣布临床死亡。
1.2 尸体检验
尸表检查:右下腹见斜行瘢痕,其下可触及一包块(移植肾)。左前臂上段前侧及外侧分别见3.5 cm×2.0 cm、3.8 cm×2.5 cm静脉造瘘瘢痕。
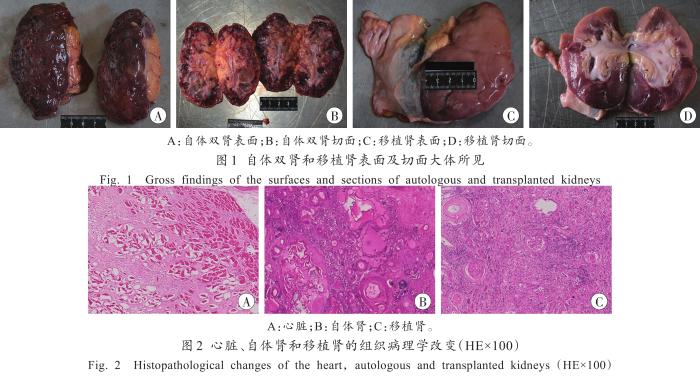
尸体解剖:心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm。左肾质量84 g,大小为10.0 cm×5.8 cm×4.6 cm;右肾质量79 g,大小为9.7 cm×6.0 cm×4.0 cm;双肾表面及切面见弥漫性大小不一的囊肿,表面凹凸不平,皮髓质变薄、界限不清(图1A~B)。右侧腹膜外见一11.5 cm×8.0 cm包块,其内包裹一移植肾,移植肾质量165 g,大小为11.5 cm×7.5 cm×4.6 cm,表面见散在点灶状白色斑片病灶,切面皮髓质界限欠清楚(图1C~D)。余未见明显异常。
组织病理学检验:左冠状动脉前降支、左旋支及右冠状动脉粥样硬化,管腔狭窄Ⅰ~Ⅱ级;部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱;部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕(图2A)。多数肺泡腔内见均质粉染水肿液,间质血管扩张、淤血。自体肾组织内可见弥漫性大小不等的囊腔,囊壁被覆立方上皮并脱落入囊腔内,部分囊腔内充满均质粉染液;大部分肾实质消失,囊腔之间的肾实质内未见肾小球结构,多数肾小管萎缩、基底膜增厚(图2B)。移植肾组织内可见部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚;部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型;间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变(图2C~D)。脑、心、脾、肾等器官小动脉硬化。
法医病理学诊断:多囊肾,肾移植术后,肾移植排斥反应;尿毒症心肌病,冠状动脉粥样硬化(Ⅰ~Ⅱ级),急、慢性心肌缺血;全身多器官小动脉硬化;肺淤血、水肿。
1.3 鉴定意见
该男符合多囊肾病肾移植术后,因移植肾发生排斥反应致慢性肾衰竭并急性进展,同时出现尿毒症心肌病、贫血、高钾血症等并发症,终因多器官功能衰竭而死亡。
2 讨 论
多囊肾病是指以肾多发性囊肿为特征的一组疾病,是一种常见的遗传相关性疾病,分为常染色体显性遗传多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)和常染色体隐性遗传多囊肾病(autosomal recessive polycystic kidney disease,ARPKD),其中ADPKD较多见,是一种潜在的致死性单基因疾病,人群患病率为1/1 000~1/400,多见于成人[1 -2 ] 。本例尸体检验见死者双肾表面及切面弥漫性大小不一的囊肿,表面凹凸不平,肾组织内可见弥漫性大小不等的囊腔,囊壁被覆立方上皮并脱落入囊腔内,部分囊腔内充满均质粉染液,大部分肾实质消失,囊腔之间的肾实质内未见肾小球结构,多数肾小管萎缩、基底膜增厚,符合多囊肾病的诊断标准。
多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] 。肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] 。尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] 。根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状。尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] 。当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化。慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%。结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关。
慢性肾脏病(chronic kidney disease,CKD)常会引起机体内环境紊乱,进而导致严重的并发症,包括心血管疾病、高钾血症、贫血等,其中心血管疾病是最主要的并发症,也是患者死亡的主要原因。尿毒症心肌病是在慢性肾衰竭基础上因血压升高、容量负荷过重及内毒素等因素导致机体内环境紊乱而出现的心肌病变,是CKD患者心血管疾病并发症病死率高的首要原因[4 ] 。其病理特点主要表现为心肌细胞肥大变性、心肌间质纤维化、心室重塑,最终导致左心室肥厚、心脏功能失调,发生心力衰竭及心律失常[4 ,7 ] 。本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕。结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] 。另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡。
参考文献
View Option
[1]
TONG F, LIANG Y, ZHANG L, et al. Fatal liver cyst rupture in polycystic liver disease complicated with autosomal dominant polycystic kidney disease: A case report[J]. Forensic Sci Int,2016,262:e5-e8.doi:10.1016/j.forsciint.2016.03.045.
[本文引用: 2]
[2]
白英杰,张洋,董红梅,等. 多囊肾患者自发性蛛网膜下腔出血死亡1例[J].法医学杂志,2011,27(5):390-391. doi:10.3969/j.issn.1004-5619.2011.05.021.
[本文引用: 1]
BAI Y J, ZHANG Y, DONG H M, et al. Death from spontaneous subarachnoid hemorrhage in patients with polycystic kidney diease: A case report[J]. Fayixue Zazhi,2011,27(5):390-391.
[本文引用: 1]
[3]
COLBERT G B, ELRGGAL M E, GAUR L, et al. Update and review of adult polycystic kidney disease[J]. Dis Mon,2020,66(5):100887. doi:10.1016/j.disamonth.2019.100887.
[本文引用: 1]
[4]
蒲玲,丁国华. 尿毒症心肌病的诊断与治疗研究进展[J].疑难病杂志,2020,19(3):302-306. doi:10.3969/j.issn.1671-6450.2020.03.020.
[本文引用: 4]
PU L, DING G H. Research progress in diagnosis and treatment of uremic cardiomyopathy[J]. Yinanbing Zazhi,2020,19(3):302-306.
[本文引用: 4]
[5]
中华医学会器官移植学分会. 肾移植排斥反应临床诊疗技术规范(2019版)[J].器官移植,2019,10(5):505-512. doi:10.3969/j.issn.1674-7445.2019.05.008.
[本文引用: 3]
Chinese Society of Organ Transplantation, Chinese Medical Association. Technical specification for clinical diagnosis and treatment of renal transplant rejection (2019 edition)[J]. Qiguan Yizhi,2019,10(5):505-512.
[本文引用: 3]
[6]
谭亚晴,任立国,任兴华,等. 交通事故致自身慢性肾衰竭急性进展死亡1例[J].中国法医学杂志,2019,34(4):417-418. doi:10.13618/j.issn.1001-5728.2019.04.029.
[本文引用: 1]
TAN Y Q, REN L G, REN X H, et al. Acute progression death from chronic renal failure caused by traffic accident: A case report[J]. Zhongguo Fayixue Zazhi,2019,34(4):417-418.
[本文引用: 1]
[7]
RADHAKRISHNAN A, PICKUP L C, PRICE A M, et al. Coronary microvascular dysfunction: A key step in the development of uraemic cardiomyopathy?[J]. Heart,2019,105(17):1302-1309. doi:10.1136/heartjnl-2019-315138.
[本文引用: 1]
[8]
吴蓝津,吴万芬,陆山河. NT-proBNP在心力衰竭中应用的研究进展[J].心血管康复医学杂志,2018,27(1):114-117. doi:10.3969/j.issn.1008-0074.2018.01.32.
[本文引用: 1]
WU L J, WU W F, LU S H. Research progress for NT-proBNP application in heart failure[J]. Xin-xueguan Kangfu Yixue Zazhi,2018,27(1):114-117.
[本文引用: 1]
[9]
NUHU F, BHANDARI S. Oxidative stress and cardiovascular complications in chronic kidney disease, the impact of anaemia[J]. Pharmaceuticals (Basel),2018,11(4):103. doi:10.3390/ph11040103.
[本文引用: 1]
2
... 多囊肾病是指以肾多发性囊肿为特征的一组疾病,是一种常见的遗传相关性疾病,分为常染色体显性遗传多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)和常染色体隐性遗传多囊肾病(autosomal recessive polycystic kidney disease,ARPKD),其中ADPKD较多见,是一种潜在的致死性单基因疾病,人群患病率为1/1 000~1/400,多见于成人[1 -2 ] .本例尸体检验见死者双肾表面及切面弥漫性大小不一的囊肿,表面凹凸不平,肾组织内可见弥漫性大小不等的囊腔,囊壁被覆立方上皮并脱落入囊腔内,部分囊腔内充满均质粉染液,大部分肾实质消失,囊腔之间的肾实质内未见肾小球结构,多数肾小管萎缩、基底膜增厚,符合多囊肾病的诊断标准. ...
... 多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] .肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] .尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] .根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
1
... 多囊肾病是指以肾多发性囊肿为特征的一组疾病,是一种常见的遗传相关性疾病,分为常染色体显性遗传多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)和常染色体隐性遗传多囊肾病(autosomal recessive polycystic kidney disease,ARPKD),其中ADPKD较多见,是一种潜在的致死性单基因疾病,人群患病率为1/1 000~1/400,多见于成人[1 -2 ] .本例尸体检验见死者双肾表面及切面弥漫性大小不一的囊肿,表面凹凸不平,肾组织内可见弥漫性大小不等的囊腔,囊壁被覆立方上皮并脱落入囊腔内,部分囊腔内充满均质粉染液,大部分肾实质消失,囊腔之间的肾实质内未见肾小球结构,多数肾小管萎缩、基底膜增厚,符合多囊肾病的诊断标准. ...
1
... 多囊肾病是指以肾多发性囊肿为特征的一组疾病,是一种常见的遗传相关性疾病,分为常染色体显性遗传多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)和常染色体隐性遗传多囊肾病(autosomal recessive polycystic kidney disease,ARPKD),其中ADPKD较多见,是一种潜在的致死性单基因疾病,人群患病率为1/1 000~1/400,多见于成人[1 -2 ] .本例尸体检验见死者双肾表面及切面弥漫性大小不一的囊肿,表面凹凸不平,肾组织内可见弥漫性大小不等的囊腔,囊壁被覆立方上皮并脱落入囊腔内,部分囊腔内充满均质粉染液,大部分肾实质消失,囊腔之间的肾实质内未见肾小球结构,多数肾小管萎缩、基底膜增厚,符合多囊肾病的诊断标准. ...
1
... 多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] .肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] .尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] .根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
4
... 多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] .肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] .尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] .根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
... 慢性肾脏病(chronic kidney disease,CKD)常会引起机体内环境紊乱,进而导致严重的并发症,包括心血管疾病、高钾血症、贫血等,其中心血管疾病是最主要的并发症,也是患者死亡的主要原因.尿毒症心肌病是在慢性肾衰竭基础上因血压升高、容量负荷过重及内毒素等因素导致机体内环境紊乱而出现的心肌病变,是CKD患者心血管疾病并发症病死率高的首要原因[4 ] .其病理特点主要表现为心肌细胞肥大变性、心肌间质纤维化、心室重塑,最终导致左心室肥厚、心脏功能失调,发生心力衰竭及心律失常[4 ,7 ] .本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕.结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] .另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
... [4 ,7 ].本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕.结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] .另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
... [4 ].另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
4
... 多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] .肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] .尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] .根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
... 慢性肾脏病(chronic kidney disease,CKD)常会引起机体内环境紊乱,进而导致严重的并发症,包括心血管疾病、高钾血症、贫血等,其中心血管疾病是最主要的并发症,也是患者死亡的主要原因.尿毒症心肌病是在慢性肾衰竭基础上因血压升高、容量负荷过重及内毒素等因素导致机体内环境紊乱而出现的心肌病变,是CKD患者心血管疾病并发症病死率高的首要原因[4 ] .其病理特点主要表现为心肌细胞肥大变性、心肌间质纤维化、心室重塑,最终导致左心室肥厚、心脏功能失调,发生心力衰竭及心律失常[4 ,7 ] .本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕.结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] .另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
... [4 ,7 ].本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕.结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] .另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
... [4 ].另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
3
... 多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] .肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] .尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] .根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
... [5 ].根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
... [5 ].当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
3
... 多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] .肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] .尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] .根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
... [5 ].根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
... [5 ].当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
1
... 多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] .肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] .尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] .根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
1
... 多囊肾病发病率高,预后差,危害极大,约有50%的患者在60岁以后会发展至尿毒症期,引起终末期肾病(end-stage renal disease,ESRD)[1 ,3 ] .肾替代治疗是目前临床常用的改善尿毒症患者症状的治疗方法,包括同种异体肾移植、血液透析和腹膜透析,其中同种异体肾移植是目前治疗尿毒症最有效的方法,但肾移植术后排斥反应是影响移植肾长期存活的首要独立危险因素[4 -5 ] .尤其是慢性排斥反应,会导致慢性肾衰竭(chronic renal failure,CRF),严重损害移植肾的功能和受者的生活质量[5 ] .根据临床资料记载,本例中该男肾移植术后存在排斥反应,血清肌酐进行性上升,并出现眼睑、双下肢水肿,夜间胸痛伴憋气,恶心,呕吐,饮食差,睡眠差,小便量少,提示其移植肾可能存在慢性肾衰竭并发尿毒症症状.尸体检验见死者移植肾部分肾小球玻璃样变和纤维化,部分毛细血管球萎缩,包曼氏囊增厚,部分肾小管变性坏死,上皮脱落,基底膜增厚,少数肾小管内可见管型,间质内散在灶性淋巴细胞浸润,小动脉管壁增厚,可见葱皮样改变,符合移植肾出现慢性排斥反应的病理学改变特征[5 ] .当慢性肾衰竭患者受到某些因素刺激时可导致肾功能突然恶化.慢性肾衰竭急性加重的诊断标准[6 ] 包括:(1)原患有慢性肾衰竭;(2)数日或数周内血清肌酐较原基础值升高50%和(或)肌酐清除率较前下降15%;(3)有明确的加重因素;(4)经积极治疗后,血清肌酐下降50%或肌酐清除率上升15%.结合本例病程具体情况,被鉴定人3月14日肌酐844.4 μmol/L,此后逐渐上升至死亡当日达2 455.0 μmol/L,考虑移植肾存在急性肾损伤,但因缺乏辅助检查,急性肾损伤的病因未明,可能与其没有进行有效的系统性治疗导致体内尿毒症毒素蓄积有关. ...
1
... 慢性肾脏病(chronic kidney disease,CKD)常会引起机体内环境紊乱,进而导致严重的并发症,包括心血管疾病、高钾血症、贫血等,其中心血管疾病是最主要的并发症,也是患者死亡的主要原因.尿毒症心肌病是在慢性肾衰竭基础上因血压升高、容量负荷过重及内毒素等因素导致机体内环境紊乱而出现的心肌病变,是CKD患者心血管疾病并发症病死率高的首要原因[4 ] .其病理特点主要表现为心肌细胞肥大变性、心肌间质纤维化、心室重塑,最终导致左心室肥厚、心脏功能失调,发生心力衰竭及心律失常[4 ,7 ] .本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕.结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] .另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
1
... 慢性肾脏病(chronic kidney disease,CKD)常会引起机体内环境紊乱,进而导致严重的并发症,包括心血管疾病、高钾血症、贫血等,其中心血管疾病是最主要的并发症,也是患者死亡的主要原因.尿毒症心肌病是在慢性肾衰竭基础上因血压升高、容量负荷过重及内毒素等因素导致机体内环境紊乱而出现的心肌病变,是CKD患者心血管疾病并发症病死率高的首要原因[4 ] .其病理特点主要表现为心肌细胞肥大变性、心肌间质纤维化、心室重塑,最终导致左心室肥厚、心脏功能失调,发生心力衰竭及心律失常[4 ,7 ] .本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕.结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] .另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
1
... 慢性肾脏病(chronic kidney disease,CKD)常会引起机体内环境紊乱,进而导致严重的并发症,包括心血管疾病、高钾血症、贫血等,其中心血管疾病是最主要的并发症,也是患者死亡的主要原因.尿毒症心肌病是在慢性肾衰竭基础上因血压升高、容量负荷过重及内毒素等因素导致机体内环境紊乱而出现的心肌病变,是CKD患者心血管疾病并发症病死率高的首要原因[4 ] .其病理特点主要表现为心肌细胞肥大变性、心肌间质纤维化、心室重塑,最终导致左心室肥厚、心脏功能失调,发生心力衰竭及心律失常[4 ,7 ] .本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕.结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] .另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...
1
... 慢性肾脏病(chronic kidney disease,CKD)常会引起机体内环境紊乱,进而导致严重的并发症,包括心血管疾病、高钾血症、贫血等,其中心血管疾病是最主要的并发症,也是患者死亡的主要原因.尿毒症心肌病是在慢性肾衰竭基础上因血压升高、容量负荷过重及内毒素等因素导致机体内环境紊乱而出现的心肌病变,是CKD患者心血管疾病并发症病死率高的首要原因[4 ] .其病理特点主要表现为心肌细胞肥大变性、心肌间质纤维化、心室重塑,最终导致左心室肥厚、心脏功能失调,发生心力衰竭及心律失常[4 ,7 ] .本例死者心脏质量651 g,左心室壁厚1.7 cm,右心室壁厚0.3 cm,室间隔厚1.9 cm,部分心肌细胞肥大,少数心肌纤维断裂,局部心肌细胞排列紊乱,部分心肌嗜伊红染色增强,肌质凝聚,横纹不清,可见心肌波浪样变,间质散在少量炎症细胞浸润,散在片灶状纤维瘢痕.结合临床病史,符合尿毒症心肌病的诊断标准,并且出现了急性心肌缺血的改变[4 ] .另外,死者死亡当日的实验室检验结果示NT-proBNP>45 000 pg/mL,血红蛋白33 g/L,血糖2.5 mmol/L,K+ 浓度6.4 mmol/L,提示其存在心力衰竭[8 ] 、重度贫血、低糖血症、高钾血症,其中任何一种并发症均可直接危及患者生命,同时重度贫血[9 ] 、低糖血症、高钾血症等会进一步加重尿毒症心肌病致急性心力衰竭,这些并发症的出现更是加速了患者的死亡. ...