DNA分型技术是刑事侦查、法律诉讼、公共安全等领域不可或缺的重要技术手段。对犯罪现场生物物证的提取鉴定愈来愈受到侦查部门的重视,尤其如隐性血迹、接触性斑迹、脱落细胞等具有较强隐蔽性的微量物证,成为勘验人员重点提取的检材[1]。面对刑事侦查工作“快检快侦”的要求,如何快速高效地检验微量物证成为当今法医DNA领域研究的热点之一。
细胞裂解试法包含了可以直接用于PCR扩增的新型人细胞裂解液,经过简单的裂解、离心,即可对反应液直接进行PCR扩增。整个提取过程始终在同一离心管中进行,最大程度降低了样本的损失和污染,体现了操作便捷、设备要求低、价廉环保等优点[2]。
本研究拟利用微量DNA直接提取试剂直接进行人细胞裂解,并与目前本实验室采用的基于磁珠法的全自动核酸提取工作站相比较,测试细胞裂解法的DNA获取效率和STR分型检验灵敏度与磁珠法的差异,进一步评估两种方法在法医学实践中的效果和运用。
1 材料与方法
1.1 样本
THP-1细胞购自中国科学研究院,新鲜人血来自1位健康的志愿献血男性,使用采血针采集。本研究人血样本来源于“全基因组范围筛选用于个体鉴别SNP遗传标记研究”项目,该项目已获得复旦大学生命科学学院伦理委员会批准[审批号:伦研批第(BE1806)号]。
1.2 主要试剂与仪器
微量DNA直接提取试剂(天津诺维莱博科技有限公司),全自动96道微量DNA提取工作站(长春市博坤生物科技有限公司),VeriFilerTM Plus PCR扩增试剂盒(美国Thermo Fisher Scientific公司),Investigator® Quantiplex® Pro试剂盒(德国QIAGEN公司),QuantStudioTM 5实时荧光定量PCR系统(美国Thermo Fisher Scientific公司),Centrifuge 5427 R-微量离心机(德国Eppendorf公司),9700型PCR仪(美国AppliedBiosystems公司),3500xL遗传分析仪(美国AppliedBiosystems公司),CytoFLEX S流式细胞仪(美国Beckman公司)。
1.3 方法
1.3.1 样本制备
THP-1细胞样本制备:使用CytoFLEX S流式细胞仪进行细胞计数,制备含不同数量THP-1细胞样本(100、400、800个)的棉签拭子。
新鲜人血样本制备:取新鲜人血,使用ddH2O进行稀释,分别制备原浓度、稀释100倍、稀释300倍、稀释500倍和稀释700倍人血样本。
1.3.2 样本提取
THP-1细胞样本提取:将棉签拭子放入微量DNA直接提取试剂的提取管中,加入裂解液60 μL,60 ℃孵育振荡10 min,20 817×g离心2 min,提取后取2 μL用于DNA定量;使用全自动96道微量DNA提取工作站对棉签拭子进行提取,提取步骤参照使用说明书,洗脱体积设为60 μL,提取后取2 μL用于DNA定量。
新鲜人血样本提取:取不同稀释倍数的新鲜人血10 μL,原浓度组对应新鲜人血量10 μL;稀释100倍对应新鲜人血量0.1 μL;稀释300倍对应新鲜人血量0.033 μL;稀释500倍对应新鲜人血量0.02 μL;稀释700倍对应新鲜人血量0.014 μL。取新鲜人血样品放入微量DNA直接提取试剂的提取管中,加入裂解液90 μL,60℃孵育振荡10 min,20 817×g离心2 min,提取后取10 μL用于STR分型检测。使用全自动96道微量DNA提取工作站对新鲜人血样品进行提取,提取步骤参照使用说明书,取样品10 μL,洗脱体积设为100 μL,提取后取10 μL用于STR分型检测。
1.3.3 DNA定量
取DNA模板2 μL采用Investigator® Quantiplex® Pro试剂盒在QuantStudioTM 5实时荧光定量PCR系统上进行定量,操作按照试剂盒说明书进行。
1.3.4 DNA扩增和分型检测
取DNA模板10 μL,使用VeriFiler TM Plus PCR扩增试剂盒25 μL体系扩增。PCR循环参数:95 ℃变性1 min;96 ℃ 10 s,62 ℃ 90 s,2个循环;96 ℃ 10 s,60 ℃ 1 min,27个循环;60 ℃延伸5 min。取扩增产物1 μL在3500xL遗传分析仪上进行毛细管电泳。采用GeneMapper®ID-X v1.5软件(美国Thermo Fisher Scientific公司)分析数据。
基因座检出率=检出基因座数/总基因座数×100。
1.3.5 DNA获取效率比较
使用细胞裂解法和磁珠法按1.3.2、1.3.3节操作,分别对含100、400、800个THP-1细胞的样本进行基因组DNA提取,提取后进行DNA定量,每组重复5次。
1.3.6 灵敏度比较
使用细胞裂解法和磁珠法分别提取不同稀释倍数人血(未稀释、稀释100倍、稀释300倍、稀释500倍和稀释700倍)DNA,提取后用于DNA扩增和STR分型检测,每组重复3次。
1.4 统计分析
使用SPSS17.0软件(美国IBM公司)对细胞裂解法与磁珠法获取不同数量THP-1细胞DNA的含量、细胞裂解法与磁珠法提取新鲜人血的D21S11基因座相对荧光单位(relative fluorescence unit,RFU)分别进行正态性验证,如果各组均满足正态性且组间方差齐性,采用独立样本t检验进行组间比较,计量数据以均值±标准差(
2 结果
2.1 细胞裂解法与磁珠法的DNA获取效率比较
当THP-1细胞数量分别为100、400、800个时,使用细胞裂解法与磁珠法提取细胞DNA的结果(表1)显示:当THP-1细胞数量为100个时,细胞裂解法提取的DNA量与磁珠法提取的DNA量之间差异无统计学意义;当THP-1细胞数量为400个和800个时,细胞裂解法获取的DNA量高于磁珠法(P<0.05)。
表1 细胞裂解法与磁珠法的DNA获取效率比较
Tab. 1
| 细胞数/个 | 细胞裂解法 | 磁珠法 | ||
|---|---|---|---|---|
| 裂解液中DNA质量浓度/(ng·μL-1) | 实际获取DNA量/ng | 提取后DNA质量浓度/(ng·μL-1) | 实际提取DNA量/ng | |
| 100 | 0.020±0.006 | 1.219±0.334 | 0.017±0.005 | 1.020±0.281 |
| 400 | 0.085±0.006 | 5.081±0.3351) | 0.061±0.005 | 3.634±0.482 |
| 800 | 0.156±0.005 | 9.332±0.3181) | 0.132±0.013 | 7.896±0.759 |
2.2 细胞裂解法与磁珠法灵敏度的比较
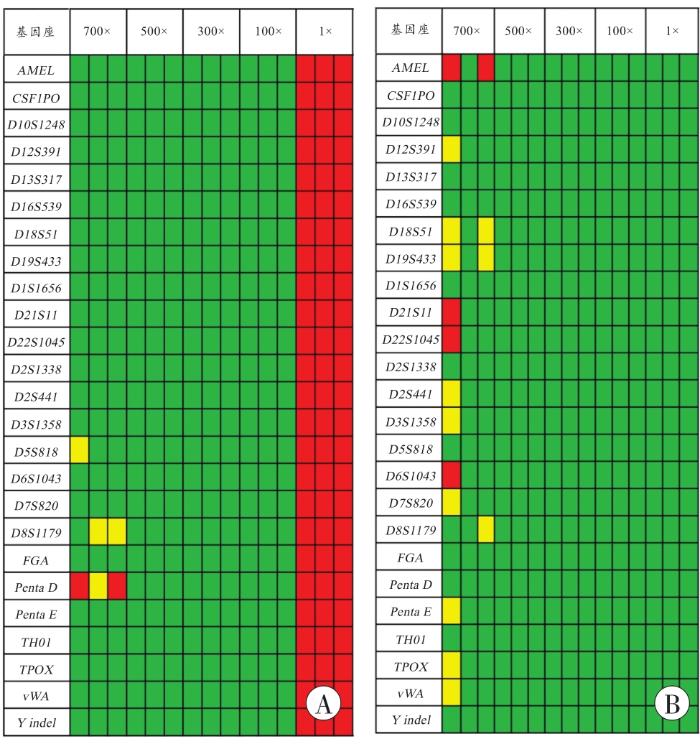
使用细胞裂解法与磁珠法提取新鲜人血的STR基因座检出情况如图1所示。
图1
图1
基因座检出情况
A:细胞裂解法;B:磁珠法。绿色表示STR分型完整;红色表示未检出STR分型;黄色表示等位基因缺失。
Fig. 1
Detection of loci
以10 μL未稀释人血作为样本时,使用细胞裂解法进行提取,经DNA扩增后,无法检出任何STR分型,而使用磁珠法提取相同样本可以获取全部STR分型;在稀释倍数为100、300、500倍时,两种方法均能完整检出血样的STR分型。在稀释倍数为700倍时,两种方法均不能完整检出血样的STR分型。使用细胞裂解法的平均基因座检出率为93.7%,使用磁珠法的平均基因座检出率为87.3%。
在稀释倍数为100、300、500倍时,两种方法在获得完整STR分型的D21S11基因座RFU值如表2所示。在稀释倍数为100倍时,使用细胞裂解法的D21S11基因座RFU值低于磁珠法(P<0.05)。在稀释倍数为300倍和500倍时,两种方法在D21S11基因座的RFU值差异无统计学意义。
表2 细胞裂解法与磁珠法的D21S11基因座RFU值比较
Tab. 2
| 血样稀释倍数/倍 | D21S11基因座RFU值 | |
|---|---|---|
| 细胞裂解法 | 磁珠法 | |
| 100 | 1 635±4221) | 3 738±514 |
| 300 | 777±429 | 1 520±418 |
| 500 | 345±86 | 461±11 |
3 讨论
本研究结果表明,当THP-1细胞数量为400个和800个时,使用细胞裂解法提取THP-1细胞DNA较磁珠法可以获得更高浓度的DNA,说明在该裂解液作用下,样本细胞内的DNA得到充分释放,由于没有转移过程,避免了DNA的损失,体现出该方法在DNA提取量上的优势。而磁珠法包括裂解、吸附、洗涤和洗脱诸多步骤,其中磁珠表面的功能团设计,反应液的离子强度和pH值,以及吸附洗涤过程均可能会影响最终的DNA回收率[6]。
在进一步的STR分型检验中,当血样稀释100、300和500倍时,细胞裂解法和磁珠法的基因座检出率均为100%(图1)。在血样稀释700倍时,两种提取法均无法获得完整的STR分型,但细胞裂解法的基因座检出率(93.7%)略高于磁珠法(87.3%)。造成这一差异的原因可能是由于细胞裂解法无需烦琐的吸附、洗涤的DNA纯化过程,最大程度保留模板DNA,从而提高了微量检材STR分型的检出率[6]。值得注意的是,使用细胞裂解法提取未稀释血样直接进行扩增,未获取STR分型,可能是由于细胞内的蛋白、多糖、盐离子等杂质未能去除干扰了后续的PCR反应。而在提取稀释700倍血样时,存在丢峰现象(图1),其平均RFU值无法反映实际扩增情况,故仅对血样稀释100、300、500倍的RFU值进行比较。在血样稀释100倍时,虽然两种提取法均获得了完整的分型,但细胞裂解法获得的D21S11基因座RFU为(1 635±422),低于磁珠法(3 738±514)(表2),呈现出抑制现象,提示在提取的产物中可能包含对PCR反应有影响的抑制成分[7]。而在血样稀释300倍和500倍时,两种方法的D21S11基因座RFU值差异无统计学意义,可能是由于随着血样的稀释,提取产物中的抑制成分浓度同时降低,同时PCR反应液经过不断优化,其抗抑制能力得到不断增强,高效的DNA聚合酶和PCR预混液具有极佳的抗抑制性和适应性,能够在复杂条件下仍保证酶的活性和复制的准确性[8]。同时发现,细胞裂解法无法获得全血样本的分型结果,说明在样本裂解过程中,DNA虽然得到充分释放,但无法有效去除细胞内的蛋白、多糖、盐离子等杂质,正是这些杂质干扰了后续的PCR反应。由此表明,细胞裂解法更适用于微量血痕物证(对应新鲜人血量≤0.1 μL)的快速提取,而非高浓度血液样本[9]。
本研究初步探索了细胞裂解法和磁珠法在法医学鉴定中的应用,比较了细胞裂解法与磁珠法在提取不同数量THP-1细胞和不同稀释倍数人血时的效果。与兼具提取和纯化功能的磁珠工作站相比,细胞裂解法无需特殊设备,操作简便,耗时更短,避免了DNA的丢失耗损,但因仅通过离心进行简单纯化,导致提取产物内的蛋白质、多糖、盐离子等未能有效去除。在检案中还需根据检材的实际情况,酌情选择适用的提取方式。后续实验将进一步探索细胞裂解法是否比磁珠法更适用于DNA含量较低的接触DNA检材或隐性斑迹的检验,以及其他常见PCR缓冲液与细胞裂解法的兼容性。
参考文献
TE-MAGS磁珠法提取效率定量研究
[J].
Quantification study of TE-MAGS magnetic bead based DNA extraction efficiency
[J].
Chemical vectors for gene delivery: A current review on polymers, peptides and lipids containing histidine or imidazole as nucleic acids carriers
[J].
磁珠法和Chelex法在微量或腐败检材DNA检验中的效果对比及探讨
[J].
Comparison and discussion on the effect of magnetic bead method and Chelex method in DNA detection of trace or corrupt samples
[J].
磁珠法在自动化核酸提取工作站中的应用
[J].
Application of magnetic bead method in automated nucleic acid extraction workstation
[J].
磁珠法自动化纯化现场检材DNA方法研究
[J].
The study for the DNA case work sample purification by the automated DNA extraction system with magnetic beads
[J].
Direct polymerase chain reaction (PCR) from human whole blood and filter-paper-dried blood by using a PCR buffer with a higher pH
[J].
Developmental validation of the AmpFℓSTR® Identifiler® Plus PCR Amplification Kit: An established multiplex assay with improved performance
[J].
改良直接扩增法应用于生物检材DNA检验
[J].
Modified direct amplification method applied to DNA detection of biological samples
[J].
微量生物物证提取套装在现场微量血痕DNA检验中的应用
[J].
Application of Trace Biological Evidence Collection Kit in DNA examination of trace bloodstain samples from the scene
[J].