本研究收集死后不同时间点大鼠骨骼肌及人体骨骼肌样本,采用蛋白质芯片检测技术获取死后蛋白质表达谱,通过多维统计方法,探索蛋白质含量变化与死亡时间的关系,建立死亡时间预测模型,为死亡时间推断提供新的思路和技术支持。
1 材料与方法
1.1 样本制备
健康成年雄性SD大鼠8只,10~12周龄,体质量200~230 g,由山西医科大学实验动物中心提供。温室饲养2 d,腹腔注射20%乌拉坦(1 g/kg,北京索莱宝科技有限公司)麻醉后颈椎脱臼处死,死后放入16 ℃人工气候箱。于死后0 d、1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d和9 d分别取每只大鼠右后肢腓肠肌(200±2) mg,重复收集大鼠的肌肉组织样本,每次收集后保持皮肤覆盖,共收集80份样本。样本于液氮速冻后放入-80 ℃冰箱待检。
收集2021年山西医科大学司法鉴定中心9例不同死亡时间人体骨骼肌样本,按序编为1~9号,其中3例经冷藏(计算死亡时间时除去尸体冷藏时间),样本信息详见表1。样本均为无损伤、无出血的胸大肌,每份肌肉组织为(200±2) mg,于液氮速冻后放入-80 ℃冰箱待检。
表1 9例人体样本的详细信息
Tab. 1
| 案例 | 年龄/岁 | 性别 | 是否冷藏 | 死亡原因 | 死亡时间 |
|---|---|---|---|---|---|
| 1 | 69 | 女 | 否 | 交通事故 | 4 d |
| 2 | 32 | 男 | 否 | 锐器伤 | 12 h |
| 3 | 37 | 男 | 否 | 锐器伤 | 16 h |
| 4 | 52 | 男 | 否 | 棍棒伤 | 5.5 h |
| 5 | 53 | 男 | 否 | 锐器伤 | 20 h |
| 6 | 47 | 男 | 否 | 冠心病 | 22 h |
| 7 | 12 | 男 | 是 | 中暑死 | 20~25 h |
| 8 | 51 | 男 | 是 | 锐器伤 | 5~10 h |
| 9 | 49 | 男 | 是 | 锐器伤 | 15~20 h |
本研究已获得山西医科大学科学研究伦理审查委员会批准(审批文号:2020LL149)。
1.2 蛋白质提取
将大鼠和人体的骨骼肌在液氮中研磨至粉末状后置入微量离心管,同时将蛋白酶抑制剂苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF;武汉博士德生物工程有限公司)与纯水按1∶3.5的质量浓度比(kg/L)加入离心管,冰上孵育1 h,以12 000×g离心20 min,吸取上清液400 μL分装备用。
从每只大鼠10个时间点的蛋白上清液中各取50 μL,混匀制成400 μL的质量控制(quality control,QC)样本,共8份。
1.3 蛋白质芯片样本制备及检测
根据蛋白质230试剂盒(美国Agilent公司)说明书在4 μL样本中加入2 μL变性剂,将样本溶液和Ladder置入100 ℃水浴中加热5 min,再加入84 μL去离子水进一步稀释,从稀释液中取6 μL加载到蛋白质芯片相应的孔道中。
每个芯片加载10个样本,然后将芯片置于2100生物分析仪中进行分析,20~30 min后,获取每个样本相对分子质量为14 000~230 000的水溶性蛋白质表达谱数据。
1.4 数据预处理
采用2100 Expert软件(美国Agilent公司)获取大鼠和人体骨骼肌蛋白质凝胶电泳图和电泳色谱图。根据内标“lower marker”和“upper marker”对电泳色谱进行定标识别,并对峰位进行校正调整。为消除杂质干扰,去除荧光强度在10 FU以下的峰[12]。将迁移时间(相对分子质量大小)基本一致的峰记为相同编号,对峰含量进行归一化处理。
1.5 统计分析
使用SPSS 22.0软件(美国IBM公司)对8份QC样本进行单因素方差分析,检验组间是否存在差异;再行多重比较最小显著性差异(least significant difference,LSD)检验,分析QC样本是否存在差异。采用SIMCA 14.1软件(瑞典Umetrics公司)对死后各时间点大鼠骨骼肌样本的峰高数据进行主成分分析(principal component analysis,PCA)降维,结合正交偏最小二乘(orthogonal partial least squares,OPLS)判别分析死后各时间点之间的差异,其中R2、Q2表示模型的解释能力和预测能力,R2、Q2终点越接近,同时Q2回归直线与Y轴有负截距,说明模型有效,无过度拟合现象。R2X、R2Y分别为模型对自变量X、因变量Y的解释能力。当Q2>0.5且与R2Y差值不超过±0.3时,认为模型有效、数据可靠[13],用基于交互验证的方差分析(cross validation-analysis of variance,CV-ANOVA)检验死后不同时间点样本间的差异。采用SPSS Clementine 12.0软件(美国IBM公司)分别建立Fisher判别模型和反向传播(back propagation,BP)神经网络模型,对死后不同时间点大鼠骨骼肌样本进行分类预测,随机选取70%的数据作为训练集、30%的数据作为测试集,分别获取两个模型的内部交叉验证准确率及外部验证准确率,同时以混淆矩阵总结BP模型的预测能力。使用Morpheus分析软件(
2 结 果
2.1 大鼠骨骼肌蛋白质表达谱峰分析及模型建立
2.1.1 大鼠骨骼肌蛋白质谱峰特征及差异性
QC样本的单因素方差分析及多重比较结果表明,组间差异无统计学意义(P>0.05)。
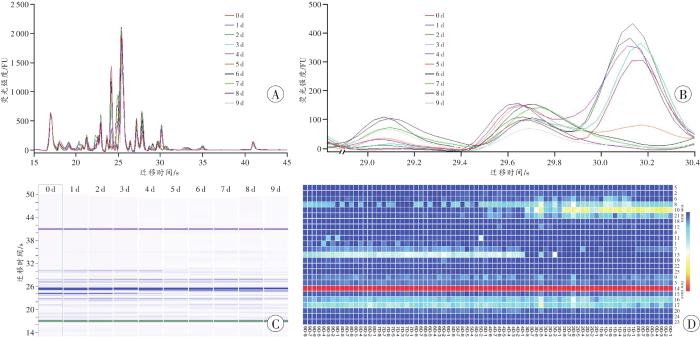
图1
图1
死后不同时间点大鼠骨骼肌蛋白质的表达
A:死后不同时间点蛋白质谱峰重叠图;B:重叠谱峰局部放大图像;C:死后不同时间点蛋白凝胶电泳图;D:识别峰含量的热图。
Fig. 1
Protein expression of rat skeletal muscles at different time points after death
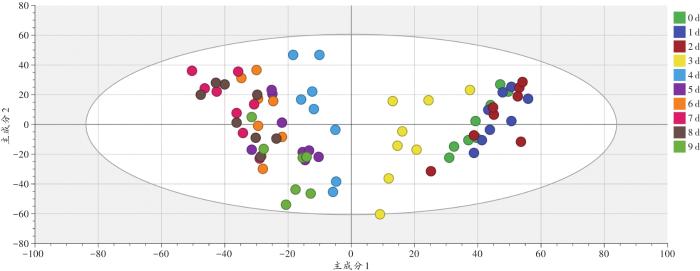
PCA模型指标良好(R2=0.866,Q2=0.654),可解释大部分的数据变异(图2)。死后不同时间点大鼠骨骼肌蛋白质谱峰随死亡时间的延长呈一定的聚集趋势,但模型为无监督学习,部分死亡时间段内差异不能完全显现,需进一步分析。
图2
图2
死后不同时间点大鼠骨骼肌蛋白质谱峰的PCA模型
Fig. 2
PCA model of rat skeletal muscle protein peaks at different time points after death
组间OPLS判别分析发现,死后0 d、1 d、2 d、3 d、4 d、5 d和9 d两两时间点间均可分离,模型R2、Q2值均大于0.5,且CV-ANOVA结果显示各组间差异均有统计学意义(P<0.05);6 d、7 d、8 d 3个时间点间较难分离且CV-ANOVA中P>0.05。
2.1.2 死亡时间预测模型
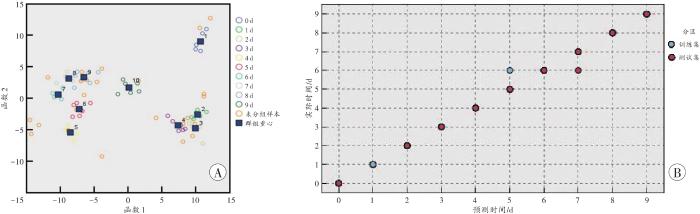
对80份大鼠骨骼肌蛋白质样本进行Fisher判别分析,典型判别函数图显示死后10个时间点分离效果尚可(图3A),但部分样本存在重叠交叉现象,模型内部交叉验证和外部验证的准确率分别为71.4%和66.7%,准确率较低。
图3
图3
大鼠骨骼肌蛋白质样本的死亡时间预测模型
A:Fisher判别模型;B:BP神经网络模型。
Fig. 3
Prediction model of postmortem interval in protein samples from rat skeletal muscles
以蛋白质样本为数据节点、死亡时间为输出节点、25个峰为输入节点的BP神经网络模型中,内部交叉验证和外部验证的准确率分别为98.2%和95.8%,以混淆矩阵结合散点图判断BP神经网络模型分类预测结果中,行代表预测时间点,列代表实际时间点,发现在5 d、7 d各有1例错判(图3B)。
经两种模型的比较,BP神经网络模型具有良好的稳定性和对未知样本的预测能力。
2.2 人体骨骼肌蛋白质表达谱峰分析
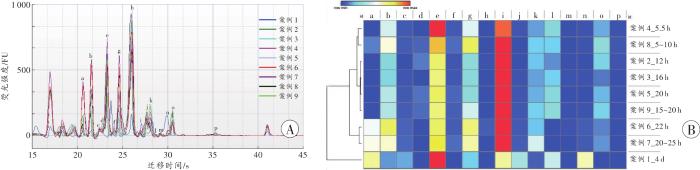
将人体骨骼肌蛋白质样本中识别出的16个峰按序标记为a~p,发现各峰形状、位置基本一致(图4A)。案例1(死后4 d)样本的个别峰与其余8例略有差异,其峰识别个数最少(10个),案例6(死后22 h)样本的峰识别个数最多(13个)。
图4
图4
死后人体骨骼肌蛋白质的表达
A:谱峰全貌;B:不同死亡时间各峰含量的热图及聚类结果,横向表示识别出的16个峰,纵向表示9个案例的死亡时间,颜色由浅到深表示峰含量由少到多。
Fig. 4
Protein expression of human skeletal muscles after death
进一步探究人体蛋白质谱峰含量在不同死亡时间点的分布状态和规律,对样本数据进行热图分析,发现不同谱峰含量随死亡时间的延长发生变化,如峰a含量随时间的延长而增加,峰e含量呈现先减少后增加的趋势,峰i与峰e趋势相反。根据峰含量对死亡时间进行聚类,发现死后4 d的蛋白质样本与死后25 h内的蛋白质样本明显分离,各峰含量随死亡时间的延长呈一定的时序性变化(图4B)。
3 讨 论
本研究使用蛋白质芯片检测技术对大鼠骨骼肌蛋白质进行检测,结果显示,不同死亡时间的蛋白质芯片谱峰及峰含量具有差异,其变化趋势和程度不同。PCA是一种数据降维方法,可利用较少的综合指标来解释原始变量信息[19-20]。本研究中PCA结果显示,死后不同时间点大鼠骨骼肌蛋白质谱峰分布有一定趋势,但不能完全体现组间差异。OPLS判别分析是将连续变量数据分为预测信息和不相关信息,使结果更易解释和可视化[21]。本研究对死后不同时间点的蛋白质表达进行OPLS判别分析发现,除死后6 d、7 d和8 d外,其余7个时间点间差异均有统计学意义(P<0.05),可能与蛋白质降解产物类型、降解速率及个体差异等因素有关。
本研究对大鼠样本进行PCA及OPLS判别分析发现,蛋白质表达谱随死亡时间的延长呈时序性变化,死亡时间分类预测模型具有较高准确率,与李文晋等[12]前期发现的肝组织蛋白质不同死亡时间变化规律相一致。基于动物样本分析结果,本研究收集人体骨骼肌蛋白质样本,发现不同死亡时间的芯片谱峰存在差异,谱峰含量随死亡时间的延长发生变化。根据谱峰含量对死亡时间进行聚类分析,发现样本在死后4 d和25 h两个时间点明显区分,各峰含量亦随死亡时间延长呈现一定变化,说明蛋白质芯片检测技术可应用于动物和人体样本的死亡时间研究。此外,人体样本死亡时间多在25 h内,时间跨度小,且受死亡原因、现场环境条件和死后保存条件等多种因素影响,信息较为复杂。基于多方面因素的影响,本研究未能建立人体死亡时间推断的数学模型。
综上所述,蛋白质芯片检测技术可快速、准确、高重复性地获取死后不同时间点动物和人体骨骼肌组织相对分子质量为14 000~230 000的水溶性蛋白质表达谱,结合PCA、OPLS多维统计方法探索死后蛋白质表达与死亡时间之间的变化规律,建立多种死亡时间推断模型,其中BP神经网络更适于多指标联合死亡时间推断,可为死亡时间推断提供新的思路和方法。本研究在实验动物模型的制备上尽可能模拟实际情况,如设置多个死后时间点、增加多种死亡原因、尸体冷藏等处理方法,后续将扩大尸体样本的收集,完善相关信息,以期建立基于真实案例下的人体死亡时间蛋白质信息库。
参考文献
Best practice in forensic entomology -- Standards and guidelines
[J].
Using accumulated degree-days to estimate the postmortem interval from decomposed human remains
[J].
Profiling of RNA degradation for estimation of post mortem interval
[J].
Quantification of mRNA degradation as possible indicator of postmortem interval -- A pilot study
[J].
08.001
.
DNA methylation results depend on DNA integrity-role of post mortem interval
[J].
RD, BASS W M, RIGGSBY W S,
et al. The autodegradation of deoxyribonucleic acid (DNA) in human rib bone and its relationship to the time interval since death[J].
Delimitation of the time of death by immunohistochemical detection of thyroglobulin
[J].
Temperature-dependent postmortem changes in human cardiac troponin-T (cTnT): An approach in estimation of time since death
[J].
Postmortem muscle protein degradation in humans as a tool for PMI delimitation
[J].
Rapid seafood species identification using chip-based capillary electrophoresis and protein pattern matching
[J].
Venom on-a-chip: A fast and efficient method for comparative venomics
[J].
蛋白芯片检测技术结合多维统计推断死亡时间
[J].
Estimating postmortem interval by protein chip detection technology combined with multidimensional statistics
[J].
Principles and applications
[M].
Postmortem proteomics to discover biomarkers for forensic PMI estimation
[J].
Application of MALDI-TOF MS for estimating the postmortem interval in rat muscle samples
[J].
Postmortem protein degradation as a tool to estimate the PMI: A systematic review
[J].
蛋白质组学及其在法医病理学中的应用
[J].
Proteomics and its application in forensic pathology
[J].
MALDI-TOF MS as a novel tool for the estimation of postmortem interval in liver tissue samples
[J].
Multiscale PCA with application to multivariate statistical process monitoring
[J].
Plasma biomarkers of pulmonary hypertension identified by Fourier transform infrared spectroscopy and principal component analysis
[J].
OPLS discriminant analysis: Combining the strengths of PLS-DA and SIMCA classification
[J].
Fisher判别法的研究及应用
[D].
Research and improvement of Fisher discriminant analysis method
[D].
手足口病重症病例临床特征的Fisher逐步判别分析
[J].
Step Fisher discriminant analysis on severe clinical features of hand foot and mouth disease between enterovirus (EV) 71 and other EV
[J].
Using eye tracking to compare web page designs: A case study
[J].