甲基苯丙胺(methamphetamine,METH)是一种严重威胁公共健康和社会安全的兴奋性合成毒品,长期或高剂量使用会导致显著的神经损伤[1-2]。八肽胆囊收缩素(cholecystokinin octapeptide,CCK-8)是一种脑肠肽,可抑制METH诱导的氧化应激和神经炎症作用[3-5]。CCK-8通过与胆囊收缩素(cholecystokinin,CCK)受体结合发挥作用,主要包括胆囊收缩素1受体(cholecystokinin 1 receptor,CCK1R)和CCK2R两种亚型。同时,CCK-8与CCK受体结合后可激活β-制动蛋白(β-arrestin)偏向性信号途径,发挥抗凋亡作用[6-7]。本研究拟探讨CCK-8参与METH诱导神经元凋亡的受体机制以及β-arrestin偏向性信号途径在其中的作用,从而进一步阐明METH的毒理学机制,为METH滥用相关案件的法医学鉴识提供新思路。
1 材料与方法
1.1 主要试剂与仪器
人神经母细胞瘤SH-SY5Y细胞(上海拜力生物科技有限公司),人胚肾细胞HEK-293[青旗(上海)生物技术发展有限公司]。DMEM培养基、DMEM/F-12培养基、Opti-MEMTM I减血清培养基(美国Thermo Fisher Scientific公司)。METH由北京市公安局提供。CCK-8(26-33,德国Merck公司)。鼠抗Bax、鼠抗Bcl-2、鼠抗caspase-3/p17/p19、鼠抗β-actin(美国Proteintech Group公司),兔抗CCK-AR(F-6)、兔抗CCK-BR(E-3)(美国Santa Cruz Biotechnology公司),兔抗β-arrestin 2(C16D9,美国Cell Signaling Technology公司),兔抗cleaved caspase-3(Asp175,美国Affinity公司),羊抗鼠二抗(IRDye800CW)、羊抗兔二抗(IRDye700CW)(美国LI-COR公司),羊抗兔IgG二抗(DyLight 594荧光标记)、羊抗兔IgG二抗(DyLight 488荧光标记)(武汉Abbkine Scientific公司)。FITC Annexin Ⅴ Apoptosis Detection Kit Ⅰ(美国BD公司)。Hoechst 33258溶液(德国Merck公司)。聚凝胺(polybrene)助转染试剂[汉恒生物科技(上海)有限公司],LipofectamineTM 2000 CD转染试剂(美国Thermo Fisher Scientific公司)。慢病毒空载体LV-CMV-mCherry-WPRE、LV-CMV-EGFP-WPRE和慢病毒过表达载体LV-CMV-mCherry-CCK1R-Flag-WPRE-pA、LV-CMV-EGFP-CCK2R-HA-WPRE-pA均由武汉枢密脑科学技术有限公司合成。
FACSAriaTM Ⅲ细胞分选仪(美国BD公司),Odyssey双色红外荧光成像系统(美国LI-COR公司),Trans-Blot® TurboTM全能型蛋白转印系统(美国Bio-Rad公司),TCS SP8 CARS共聚焦显微镜、DMI4000B型倒置荧光显微镜(德国Leica公司),二氧化碳(CO2)培养箱(美国Thermo Fisher Scientific公司)。
1.2 细胞培养
人神经母细胞瘤SH-SY5Y细胞采用DMEM/F-12培养基进行培养,人胚肾细胞HEK-293采用DMEM培养基进行培养。培养条件:37 ℃、5% CO2,待细胞贴壁面积达80%~90%时,根据细胞计数,以1×105个/mL计算传代比例进行传代。
1.3 慢病毒转染HEK293-CCK1R和HEK293-CCK2R细胞的构建
为了确定CCK-8抑制METH诱导细胞凋亡的受体机制,采用慢病毒转染构建HEK293-CCK1R和HEK293-CCK2R细胞。转染前24 h,以5×104~10×104个细胞/孔的密度接种至24孔板,使细胞在病毒转染时的融合度达50%~60%。设置转染的感染复数(multiplicity of infection,MOI)梯度为12、25、50、100,根据计算公式[MOI×1 000×接种细胞数目/病毒滴度(TU/mL)]计算每孔所需的病毒载体和空载病毒的体积,弃去原培养液,加入含聚凝胺(polybrene)助转染试剂(终质量浓度为8 g/mL)的5%胎牛血清DMEM培养基,加入慢病毒孵育,转染16~24 h后换液,吸出含慢病毒颗粒的培养液,换液后继续培养48 h(转染后72 h)后,在荧光显微镜下观察细胞状态及表达率。若细胞密度达80%~90%则可进行传代,改用10%胎牛血清DMEM培养基培养,确定最适MOI后进行正式实验,并采用免疫荧光染色观察CCK1R和CCK2R的表达情况。
1.4 干扰小RNA(small interfering RNA,siRNA)转染
转染前24 h,将5×103~1×104个/孔SH-SY5Y细胞接种于不含抗生素的10% DMEM/F-12培养基中,转染时细胞融合度为30%~50%,分别使用25 μL Opti-MEMTM Ⅰ减血清培养基稀释siRNA和LipofectamineTM 2000 CD转染试剂配制siRNA稀释液和转染复合物,先对每孔用50 μL不含抗生素的3%胎牛血清DMEM/F-12培养基进行换液,再将转染复合物以50 μL/孔加入每孔,前后轻摇细胞板混合均匀,培养4~6 h后换为3%胎牛血清DMEM/F-12培养基。
1.5 膜联蛋白V-异硫氰酸荧光素/碘化丙啶染色和流式细胞术
采用膜联蛋白V-异硫氰酸荧光素/碘化丙啶(annexin Ⅴ-fluorescein isothiocyanate/propidium iodide,Annexin Ⅴ-FITC/PI)染色和流式细胞术检测细胞凋亡率。使用胰蛋白酶消化细胞,取细胞悬液100 μL经过磷酸盐缓冲液(phosphate buffer saline,PBS)清洗、离心和重悬后进行细胞计数,根据FITC Annexin Ⅴ Apoptosis Detection Kit Ⅰ说明书要求,加入5 μL FITC标记的膜联蛋白V和5 μL PI于细胞悬液中,室温避光孵育15 min,加400 μL 1×结合液至每管中混匀,冰上放置等待检测。根据流式细胞术报告图中右上和右下象限的细胞计数总和计算细胞凋亡率。
1.6 Hoechst 33258染色
将人神经母细胞瘤SH-SY5Y细胞接种培养于10% DMEM/F-12培养基中,待贴壁细胞达80%时,弃去培养液,PBS冲洗2次,胰蛋白酶消化后收集细胞,PBS重悬细胞,以离心半径10 cm,1 000 r/min,离心5 min,制备细胞悬液涂片,用溶液(V甲醇∶V冰乙酸=3∶1)固定后避光保存,使用Hoechst 33258溶液处理,双蒸水洗涤2次后封片,在共聚焦显微镜下观察。
1.7 Western印迹法
采用Western印迹法对细胞凋亡相关蛋白Bax、Bcl-2和活化型胱天蛋白酶3(cleaved caspase-3)进行检测。基本流程:裂解细胞并提取细胞总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法蛋白定量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、半干转膜,脱脂牛奶封闭,一抗[鼠抗β-actin、鼠抗Bax、鼠抗Bcl-2、鼠抗caspase-3/p17/p19、兔抗CCK-AR(F-6)、兔抗CCK-BR(E-3)、兔抗β-arrestin 2(C16D9)、兔抗cleaved caspase-3(Asp175)]孵育,洗膜,二抗[羊抗鼠二抗(IRDye800CW)、羊抗兔二抗(IRDye700CW)]孵育,采用双色红外荧光成像系统显影和ImageJ 1.0软件(
1.8 实验流程
1.8.1 METH诱导细胞凋亡模型的建立
实验分为3组:对照组、1 mmol/L METH组和2 mmol/L METH组。将SH-SY5Y细胞以2×105个/mL接种于6孔板或含圆形玻片的24孔板,采用无血清培养基处理细胞12 h。将200 mmol/L METH用无血清培养基稀释至终浓度为1、2 mmol/L,并分别处理SH-SY5Y细胞24 h。对照组使用空白的无血清培养基处理细胞24 h。每组设置3个复孔。收集细胞后,应用流式细胞术检测SH-SY5Y细胞的凋亡率。采用4%多聚甲醛溶液固定后,Hoechst 33258溶液染色,共聚焦显微镜下观察不同浓度METH诱导的SH-SY5Y细胞的形态学改变。
1.8.2 METH诱导细胞凋亡相关蛋白的表达变化
实验分为5组:0、6、12、18和24 h组。将SH-SY5Y细胞以2×105个/mL接种于细胞培养瓶。每组均用2 mmol/L METH处理,在上述时间点收取细胞。采用Western印迹法检测凋亡相关蛋白Bax、Bcl-2、cleaved caspase-3和caspase-3的表达变化。
1.8.3 CCK-8对METH诱导细胞凋亡率的作用
实验分为8组:对照组、2 mmol/L METH组、0.01 μmol/L CCK-8+2 mmol/L METH组、0.1 μmol/L CCK-8+2 mmol/L METH组、1 μmol/L CCK-8+2 mmol/L METH组、0.01 μmol/L CCK-8组、0.1 μmol/L CCK-8组、1 μmol/L CCK-8组。其中,对照组不予METH和CCK-8处理。将CCK-8用无血清培养基稀释至终浓度为0.01、0.1、1 μmol/L 3个浓度,细胞先用不同浓度CCK-8预处理(对照组用无血清培养基预处理)12 h,再给予2 mmol/L METH作用24 h。应用FACSAriaTM Ⅲ细胞分选仪和Hoechst 33258染色检测SH-SY5Y细胞的凋亡率。
1.8.4 CCK-8对METH诱导神经元凋亡的凋亡相关蛋白的作用
实验分为5组:对照组、2 mmol/L METH组、0.01 μmol/L CCK-8+2 mmol/L METH组、0.1 μmol/L CCK-8+2 mmol/L METH组、1 μmol/L CCK-8+2 mmol/L METH组。不同浓度CCK-8预处理12 h后再用2 mmol/L METH作用18 h,采用Western印迹法检测凋亡相关蛋白Bax、Bcl-2、cleaved caspase-3和caspase-3的表达变化。
1.8.5 HEK293-CCK1R和HEK293-CCK2R稳定转染细胞系的转染效率检测
慢病毒空载体LV-CMV-mCherry-WPRE、LV-CMV-EGFP-WPRE分别转染HEK293细胞24 h后,于荧光显微镜下观察病毒空载荧光表达,确定病毒转染和荧光蛋白表达正常。随后采用慢病毒过表达载体LV-CMV-mCherry-CCK1R-HA-WPRE-pA和LV-CMV-EGFP-CCK2R-Flag-WPRE-pA分别转染HEK293细胞,建立HEK293-CCK1R和HEK293-CCK2R稳定转染细胞系。免疫荧光染色后采用共聚焦显微镜观察CCK1R和CCK2R的表达情况。
1.8.6 CCK-8对METH诱导HEK293-CCK1R细胞和HEK293-CCK2R细胞凋亡相关蛋白表达的作用
实验分组:HEK293-CCK1R细胞分为对照组、2 mmol/L METH组、1 μmol/L CCK-8+2 mmol/L METH组和1 μmol/L CCK-8组;HEK293-CCK2R细胞分为对照组、2 mmol/L METH组、1 μmol/L CCK-8+2 mmol/L METH组和1 μmol/L CCK-8组。不同浓度CCK-8预处理12 h后再用2 mmol/L METH作用18 h,采用Western印迹法检测凋亡相关蛋白Bax、Bcl-2、cleaved caspase-3和caspase-3的表达变化。
1.8.7 siRNA对SH-SY5Y细胞中β-arrestin 2干扰效率的检测
在进行siRNA干扰实验前,采用含不同β-arrestin 2敲减序列的siRNA对SH-SY5Y细胞处理6 h。实验分为5组:对照组、siRNA阴性对照组(未敲减序列)、β-arrestin 2 siRNA-1组、β-arrestin 2 siRNA-2组和β-arrestin 2 siRNA-3组。采用荧光显微镜观察siRNA荧光表达(FAM绿色荧光标记),Western印迹法检测转染效率。
1.8.8 CCK-8对METH诱导的β-arrestin 2敲减后SH-SY5Y细胞凋亡的影响
实验分为4组:对照组、2 mmol/L METH组、1 μmol/L CCK-8+2 mmol/L METH组、1 μmol/L CCK-8组。按照实验分组提前24 h接种细胞,细胞转染后12 h加1 μmol/L CCK-8预处理,再用2 mmol/L METH作用18 h。采用Western印迹法检测凋亡相关蛋白Bax、Bcl-2、cleaved caspase-3和caspase-3的表达变化。
1.9 统计分析
使用SPSS 21.0软件(美国IBM公司)进行统计,符合正态分布的计量资料以
2 结 果
2.1 CCK-8对METH诱导SH-SY5Y细胞凋亡的影响
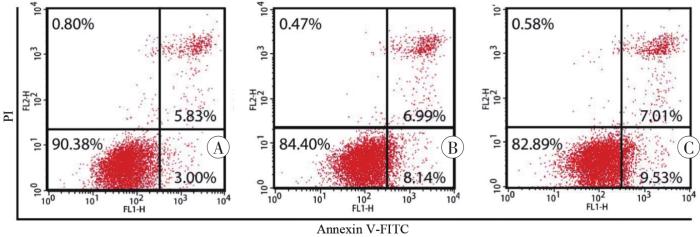
图1
图1
Annexin Ⅴ-FITC/PI染色和流式细胞术检测SH-SY5Y细胞凋亡情况
A:对照组;B:1 mmol/L METH组;C:2 mmol/L METH组。
Fig. 1
Apoptosis of SH-SY5Y cells detected by Annexin Ⅴ-FITC/PI staining and flow cytometry
表1
流式细胞术检测不同浓度METH对SH-SY5Y细胞凋亡率的影响 (n=3,
Tab. 1
| 组别 | 细胞凋亡率 |
|---|---|
| 对照 | 8.48±0.46 |
| 1 mmol/L METH | 15.05±0.921) |
| 2 mmol/L METH | 17.06±1.731) |
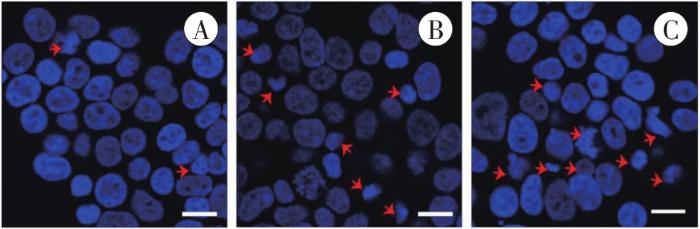
图2
图2
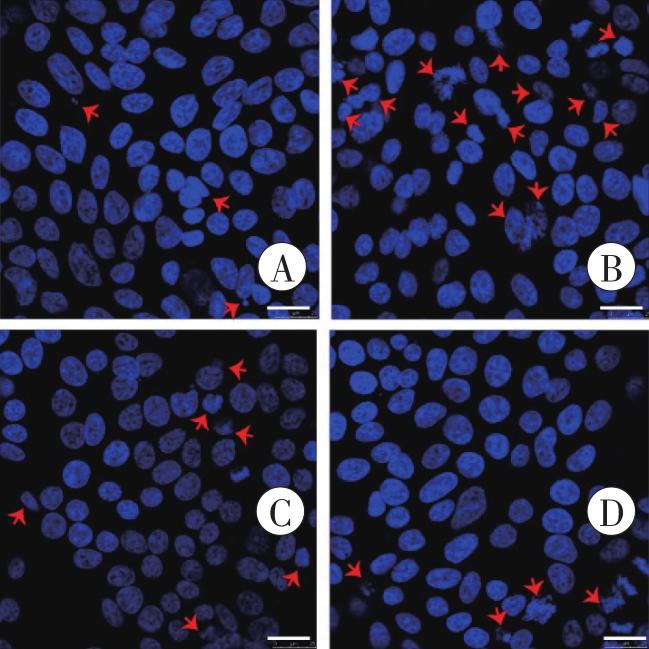
Hoechst 33258染色检测凋亡细胞核的形态学改变
A:对照组;B:1 mmol/L METH组;C:2 mmol/L METH组。红色箭头所示为碎裂、固缩的细胞核。Bar=25 μm。
Fig. 2
Morphological changes of apoptotic nucleidetected by Hoechst 33258 staining
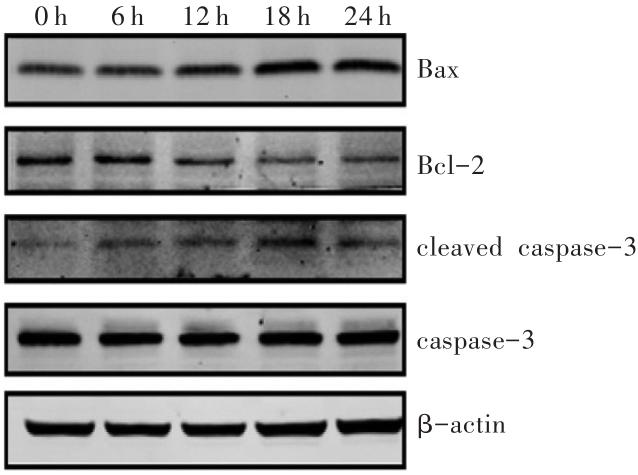
图3
图3
Western印迹法检测METH诱导SH-SY5Y细胞凋亡相关蛋白的表达
Fig. 3
Expression of apoptosis-related proteins induced byMETH in SH-SY5Y cells detected by Western blotting
表2
METH诱导SH-SY5Y细胞凋亡相关蛋白的表达变化 (n=3,
Tab. 2
| 组别 | Bax | Bcl-2 | cleaved caspase-3 | Bax/Bcl-2 |
|---|---|---|---|---|
| 0 h | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| 6 h | 1.26±0.14 | 1.08±0.16 | 1.10±0.05 | 1.26±0.31 |
| 12 h | 1.38±0.091) | 0.99±0.14 | 1.41±0.081) | 1.47±0.27 |
| 18 h | 1.56±0.051) | 0.79±0.09 | 1.46±0.061) | 2.04±0.261) |
| 24 h | 1.54±0.161) | 0.75±0.03 | 1.26±0.011) | 2.04±0.171) |
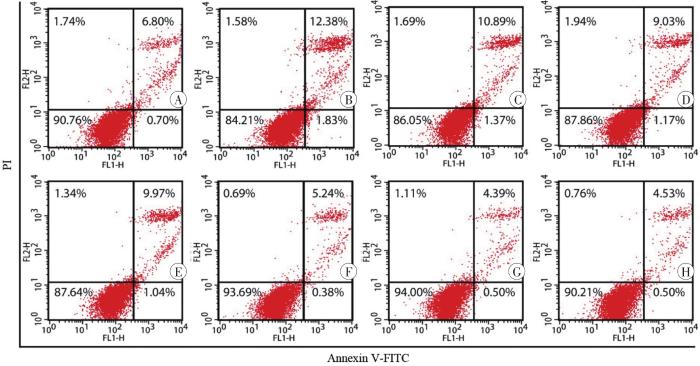
图4
图4
Annexin Ⅴ-FITC/PI染色和流式细胞术检测SH-SY5Y细胞凋亡情况
A:对照组;B:METH组;C:0.01 μmol/L CCK-8+METH组;D:0.1 μmol/L CCK-8+METH组;E:1 μmol/L CCK-8+METH组;F:0.01 μmol/L CCK-8组;G:0.1 μmol/L CCK-8组;H:1 μmol/L CCK-8组。
Fig. 4
Apoptosis of SH-SY5Y cells detected by Annexin Ⅴ-FITC/PI staining and flow cytometry
表3
流式细胞术检测不同浓度CCK-8对METH诱导SH-SY5Y细胞凋亡的影响 (n=3,
Tab. 3
| 组别 | 细胞凋亡率 |
|---|---|
| 对照 | 8.13±0.70 |
| METH | 14.18±0.40 |
| 0.01 μmol/L CCK-8+METH | 12.20±1.24 |
| 0.1 μmol/L CCK-8+METH | 10.56±0.151) |
| 1 μmol/L CCK-8+METH | 10.77±0.291) |
| 0.01 μmol/L CCK-8 | 5.76±0.73 |
| 0.1 μmol/L CCK-8 | 5.53±0.89 |
| 1 μmol/L CCK-8 | 5.95±0.84 |
图5
图5
Hoechst 33258染色检测凋亡细胞核的形态学变化
A:对照组;B:METH组;C:1 μmol/L CCK-8+METH组;D:1 μmol/L CCK-8组。红色箭头所示为碎裂、固缩的细胞核。Bar=25 μm。
Fig. 5
Morphological changes of apoptotic nucleidetected by Hoechst 33258 staining
表4
CCK-8对METH诱导SH-SY5Y细胞凋亡相关蛋白的影响 (n=3,
Tab. 4
| 组别 | Bax | Bcl-2 | cleaved caspase-3 | Bax/Bcl-2 |
|---|---|---|---|---|
| 对照 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| METH | 1.65±0.15 | 0.90±0.04 | 1.66±0.09 | 1.83±0.10 |
| 0.01 μmol/L CCK-8+METH | 1.46±0.08 | 1.16±0.13 | 1.33±0.101) | 1.31±0.221) |
| 0.1 μmol/L CCK-8+METH | 1.33±0.111) | 1.16±0.12 | 1.23±0.021) | 1.18±0.191) |
| 1 μmol/L CCK-8+METH | 1.10±0.081) | 1.29±0.131) | 1.07±0.041) | 0.86±0.081) |
图6
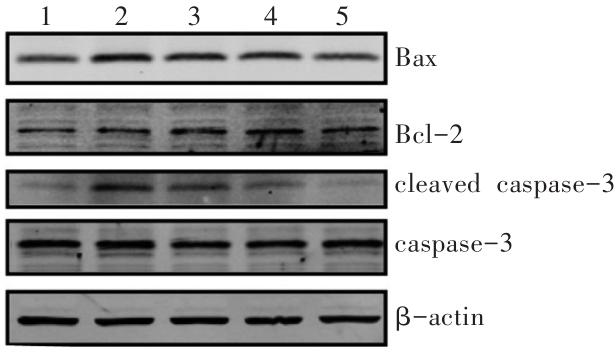
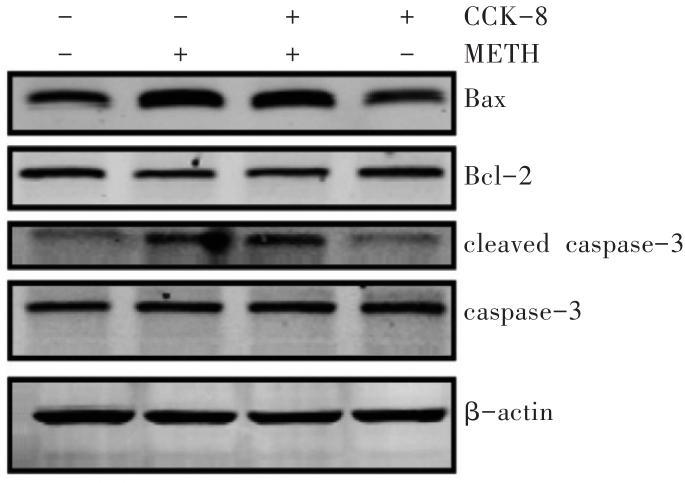
图6
Western印迹法检测CCK-8对METH诱导SH-SY5Y细胞凋亡相关蛋白的影响
1:对照组;2:METH组;3:0.01 μmol/L CCK-8+METH组;4:0.1 μmol/L CCK-8+METH组;5:1 μmol/L CCK-8+METH组。
Fig. 6
Effects of CCK-8 on the expression of apoptosis-related proteins induced by METH in SH-SY5Y cellsdetected by Western blotting
2.2 CCK-8通过CCK2R抑制METH诱导的细胞凋亡
图7
图7
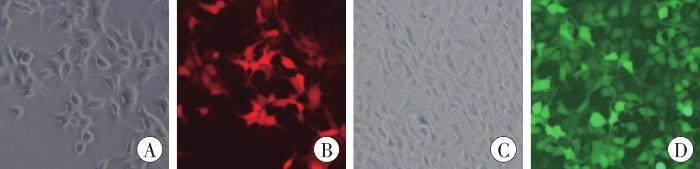
明场和荧光下慢病毒空载体转染HEK293细胞的形态(×200)
A、B为LV-CMV-mCherry-WPRE;C、D为LV-CMV-EGFP-WPRE。A、C为明场;B、D为荧光。
Fig. 7
Morphology of HEK293 cells transfected with lentivirus vectors under phase and fluorescence (×200)
图8
图8
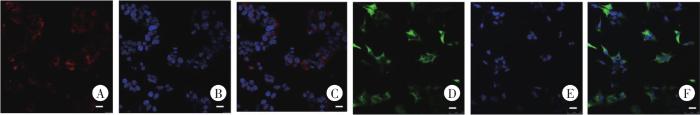
慢病毒转染HEK293细胞的激光共聚焦成像
A、B、C为LV-CMV-mCherry-CCK1R-Flag-WPRE-pA;D、E、F为LV-CMV-EGFP-CCK2R-HA-WPRE-pA。A、D为CCK1R和CCK2R的荧光标记;B、E为DAPI;C、F为Merge。Bar=20 μm。
Fig. 8
The confocal images of lentivirus-transfected HEK293 cells
图9
图9
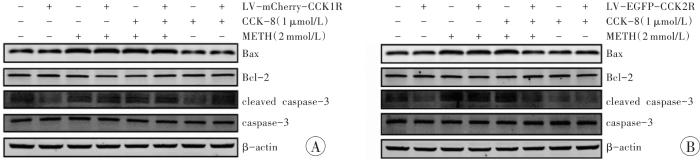
Western印迹法检测CCK-8对METH诱导HEK293-CCK1R和HEK293-CCK2R细胞凋亡相关蛋白的影响
A:HEK293-CCK1R;B:HEK293-CCK2R。
Fig. 9
Effects of CCK-8 on the expression of apoptosis-related proteins induced by METHin HEK293-CCK1R and HEK293-CCK2R detected by Western blotting
表5
CCK-8对METH诱导HEK293-CCK1R和HEK293-CCK2R细胞凋亡相关蛋白的影响 (n=3,
Tab. 5
| 蛋白 | HEK293-CCK1R | HEK293-CCK2R | ||||||
|---|---|---|---|---|---|---|---|---|
| 对照组 | METH | CCK-8+METH | CCK-8 | 对照组 | METH | CCK-8+METH | CCK-8 | |
| Bax | 1.00±0.00 | 1.65±0.08 | 1.59±0.07 | 0.94±0.02 | 1.00±0.00 | 1.67±0.13 | 1.18±0.041) | 1.11±0.13 |
| Bcl-2 | 1.00±0.00 | 0.88±0.07 | 0.91±0.09 | 0.97±0.09 | 1.00±0.00 | 0.83±0.05 | 1.00±0.15 | 0.96±0.08 |
| cleaved caspase-3 | 1.00±0.00 | 1.85±0.14 | 1.87±0.17 | 0.99±0.17 | 1.00±0.00 | 1.76±0.06 | 1.25±0.061) | 1.02±0.10 |
| Bax/Bcl-2 | 1.00±0.00 | 1.92±0.23 | 1.80±0.24 | 0.99±0.11 | 1.00±0.00 | 2.01±0.15 | 1.23±0.151) | 1.15±0.04 |
2.3 β-arrestin 2介导CCK-8对METH诱导细胞凋亡的抑制作用
图10
图10
明场和荧光下siRNA转染SH-SY5Y细胞的形态(×200)
A:明场;B:荧光。
Fig. 10
Morphology of SH-SY5Y cells transfected withsiRNA under phase and fluorescence (×200)
图11
图11
Western印迹法检测不同siRNA序列转染的SH-SY5Y细胞β-arrestin 2的表达
1:对照组;2:阴性对照组;3:β-arrestin 2 siRNA-1组;4:β-arrestin 2 siRNA-2组;5:β-arrestin 2 siRNA-3组。
Fig. 11
Expression of β-arrestin 2 in SH-SY5Y cellstransfected with different siRNA sequencesdetected by Western blotting
表6
siRNA干扰对SH-SY5Y细胞β-arrestin 2表达的影响 (n=3,
Tab. 6
| 组别 | 相对表达量 |
|---|---|
| 对照 | 1.00±0.00 |
| 阴性对照 | 1.09±0.06 |
| β-arrestin 2 siRNA-1 | 0.96±0.06 |
| β-arrestin 2 siRNA-2 | 0.61±0.041) |
| β-arrestin 2 siRNA-3 | 0.28±0.041)2) |
图12
图12
Western印迹法检测CCK-8对METH诱导β-arrestin 2敲减SH-SY5Y细胞凋亡相关蛋白的影响
Fig. 12
Effects of CCK-8 on the expression ofapoptosis-related proteins induced by METHin β-arrestin 2 knockdown SH-SY5Ydetected by Western blotting
表7
CCK-8对METH诱导β-arrestin 2敲减SH-SY5Y细胞凋亡相关蛋白的影响 (n=3,
Tab. 7
| 组别 | Bax | Bcl-2 | cleaved caspase-3 | Bax/Bcl-2 |
|---|---|---|---|---|
| 对照 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| METH | 1.81±0.041) | 0.92±0.04 | 1.80±0.071) | 1.98±0.131) |
| CCK-8+METH | 1.79±0.091) | 0.89±0.04 | 1.70±0.081) | 2.02±0.021) |
| CCK-8 | 1.07±0.02 | 1.07±0.11 | 0.91±0.05 | 1.02±0.09 |
3 讨 论
METH是目前滥用最为严重的合成毒品,长期滥用可导致一系列的神经精神症状。深入研究METH的机体损伤机制,对METH滥用相关案件的法医学鉴识具有重要意义。目前,对METH滥用引起的神经损伤已有大量治疗药物的探索性研究[8],但开发没有成瘾性且副作用小的治疗药物尤为重要。CCK-8是CCK典型的活性形式,是中枢神经系统含量最高的神经肽,其在毒品领域的应用研究始于阿片类药物的防治,其“抗阿片”作用已有广泛研究[3]。WEN等[6,9]研究发现,CCK-8具有抗感染、抗METH引起的氧化应激损伤等功能,也明显抑制重复METH暴露引起的行为改变,如活动性增加、行为敏化、刻板效应以及多巴胺能神经元毒性等。本研究选取SH-SY5Y细胞作为研究对象,该细胞系具有神经元的一般特性,是研究神经元凋亡常用的细胞模型[10]。本研究发现,CCK-8可显著抑制METH引起的SH-SY5Y细胞凋亡,提示CCK-8可能通过抗凋亡途径抑制METH的神经毒性。进一步使用CCK-8和METH先后处理SH-SY5Y细胞,利用Hoechst 33258染色观察SH-SY5Y细胞的形态,结果发现,与METH单独处理组相比,CCK-8预处理组呈致密浓染细胞核形态的比例有所减少,这在形态学上亦支持了CCK-8的抗凋亡作用。
线粒体凋亡通路中,Bax和Bcl-2是主要的凋亡调节蛋白[11],caspase-3被称为凋亡执行蛋白,当有凋亡信号刺激时,caspase酶家族成员被激活,将caspase-3裂解成活性形式cleaved caspase-3,而后者参与激活核酸内切酶,使基因链断裂从而促使细胞发生凋亡[12],检测Bax、Bcl-2、caspase-3蛋白的表达并计算Bax/Bcl-2值,能反映细胞凋亡的真实情况。研究[13]表明,METH能诱导SH-SY5Y细胞促凋亡蛋白Bax和cleaved caspase-3上调,同时抗凋亡蛋白Bcl-2下调。本研究中,METH可显著增加SH-SY5Y细胞Bax和cleaved caspase-3蛋白的表达和Bax/Bcl-2值,同时降低Bcl-2蛋白表达水平,表明在本实验条件下2 mmol/L METH可诱导SH-SY5Y细胞发生凋亡。CCK-8已被证实能通过调节线粒体凋亡通路的蛋白表达来抑制细胞凋亡[14-16]。因此,在METH给药前先给予CCK-8预处理12 h,结果发现,与METH单独处理组相比,CCK-8预处理可显著抑制METH诱导的上述凋亡相关蛋白的表达。上述结果在分子水平进一步表明了CCK-8对METH诱导神经元凋亡具有抑制作用。
CCK-8可通过与靶细胞膜表面CCK1R与CCK2R特异性结合发挥其生物学功能。CCK2R属于高敏感性受体,在中枢神经系统分布广泛,主要分布在大脑皮层、伏隔核、尾状核、海马、杏仁核、黑质和腹侧被盖区等脑区[17],而CCK1R属于低敏感性受体,主要分布在胰腺、胆囊、肠道等外周器官,但其在下丘脑、海马、迷走神经背核和脑干也有分布[18]。为了探讨CCK-8抑制METH诱导神经损伤作用的受体机制,本研究选取了HEK293细胞,该细胞系极少表达细胞外配体所需的受体,且转染效率较高,通过慢病毒转染HEK293细胞,建立稳定的HEK293-CCK1R细胞系和HEK293-CCK2R细胞系,以模拟神经系统中高表达的CCK1R和CCK2R。本研究结果显示,HEK293-CCK1R细胞和HEK293细胞中均未观察到CCK-8对METH诱导细胞凋亡的抑制作用,但是CCK-8却显著抑制了METH诱导的HEK293-CCK2R细胞凋亡。GOU等[19]采用CCK-8预处理HEK293-CCK2R细胞同样逆转了METH诱导的细胞活力降低,但在HEK293-CCK1R细胞中无明显作用。因此,CCK-8是通过CCK2R发挥抑制METH诱导的细胞凋亡作用。
在信号转导过程中,CCK受体激活后一般与磷脂酶C结合,启动三磷酸肌醇(inositol triphosphate,IP3)和甘油二酯(diacylglycerol,DG)信号,并促使细胞内 Ca2+浓度和蛋白激酶C(protein kinase C,PKC)活性升高,而PKC及Ca2+-钙调蛋白依赖性蛋白激酶可使细胞内多种底物蛋白质磷酸化,并最终产生生理效应[20]。然而,相关研究结果[7,21]显示,CCK受体下游除了与G蛋白耦联受体(G protein-coupled receptor,GPCR)结合,也可能与β-制动蛋白(β-arrestin 1或β-arrestin 2)结合发挥偏向激动作用。β-arrestin 2在神经系统高表达,可负向调节多种GPCR的功能,具有调节细胞凋亡的作用,其可能促进凋亡[22],也可能抑制凋亡[23]。本研究采用siRNA敲减SH-SY5Y细胞中的β-arrestin 2表达后,阻断了CCK-8预处理对METH诱导细胞凋亡的抑制作用,说明CCK-8通过与CCK2R结合并激活β-arrestin 2信号途径发挥其抗凋亡作用。但是,CCK2R与β-arrestin 2之间存在何种相互作用,在CCK-8和METH处理后该作用会发生何种变化,还有待在后续研究中进行深入探索。
综上所述,本研究在细胞水平和分子水平证明了CCK-8对METH诱导的细胞凋亡具有抑制作用,且CCK-8可能是与CCK2R特异性结合并通过β-arrestin 2途径抑制METH诱导的细胞凋亡,揭示了CCK-8抑制METH诱导神经损伤的信号机制,为合成毒品的毒理机制研究和METH滥用相关案件的法医学鉴识提供了新思路。
参考文献
Methamphetamine (“crystal meth”) causes induction of DNA damage and chromosomal aberrations in human derived cells
[J].
Review: The neuropathology of drug abuse
[J].
The effects of exogenous CCK-8 on the acquisition and expression of morphine-induced CPP
[J].
CCK-8与内源性阿片系统在吗啡依赖过程中的相互作用
[J].
Interaction of CCK-8 and endogenous opioid system in opioid dependence
[J].
Effects of CCK-8 on the reinstatement of morphine-induced CPP and expression of behavioral sensitization in rats
[J].
Cholecystokinin-8 inhibits methamphetamine-induced neurotoxicity via an anti-oxidative stress pathway
[J].
Early oral nutrition improves postoperative ileus through the TRPA1/CCK1-R-mediated mast cell-nerve axis
[J].
The main molecular mechanisms underlying methamphetamine- induced neurotoxicity and implications for pharmacological treatment
[J].
CCK-8 inhibits LPS-induced IL-1β production in pulmonary interstitial macrophages by modulating PKA, p38, and NF-κB pathway
[J].
神经退行性疾病研究中拟神经细胞模型:人神经母细胞瘤株SH-SY5Y的来源特性及应用
[J].
Mimic model of nerve cells in the study of neurodegenerative disease: Origin, characteristics and application of human neuroblastoma cell line SH-SY5Y
[J].
Dynamic changes of the anti- and pro-apoptotic proteins Bcl-w, Bcl-2, and Bax with Smac/Diablo mitochondrial release after photothrombotic ring stroke in rats
[J].
Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis
[J].
Melatonin reduces induction of Bax, caspase and cell death in methamphetamine-treated human neuroblastoma SH-SY5Y cultured cells
[J].
Bcl-2/Bax ratio increase does not prevent apoptosis of glia and granular neurons in patients with temporal lobe epilepsy
[J].
Influences of CCK-8 on expressions of apoptosis-related genes in prefrontal cortex neurons of morphine-relapse rats
[J].
Cholecystokinin receptor-1 mediates the inhibitory effects of exogenous cholecystokinin octapeptide on cellular morphine dependence
[J].
CCK in cerebral cortex and at the spinal level
[J].
Differential effects of cholecystokinin (CCK-8) microinjection into the ventrolateral and dorsolateral periaqueductal gray on anxiety models in Wistar rats
[J].
Protective effects of cholecystokinin-8 on methamphetamine-induced behavioral changes and dopaminergic neurodegeneration in mice
[J].
Expression of the transcription factor Egr-1 in pancreatic acinar cells following stimulation of cholecystokinin or Galphaq-coupled designer receptors
[J].
Substance P and cholecystokinin regulate neurochemical responses to cocaine and methamphetamine in the striatum
[J].
A stress response pathway in mice upregulates somatostatin level and transcription in pancreatic delta cells through Gs and β-arrestin 1
[J].
A complex structure of arrestin-2 bound to a G protein-coupled receptor
[J].