急性心肌梗死(acute myocardial infarction,AMI)是人群死亡的重要原因之一[1],其发病率呈现逐年升高的趋势[2]。动脉粥样硬化是AMI最常见的病因,几乎占年轻人AMI的90%[3]。其余10%继发于非斑块性病因,包括自发性冠状动脉夹层、冠状动脉血管痉挛、高凝状态、冠状动脉栓塞现象、自身免疫介导的炎症和药物诱导的闭塞[4]。虽然发病机制有所不同,但两种情况均会导致AMI,进而发生死亡。在法医学鉴定中,AMI者死亡过程迅速,心肌缺血时间较短,死后常缺乏客观的法医学诊断指标,其精准鉴定是法医病理学的一大难题。因此,寻找准确、可靠的生物标志物已成为法医学亟待解决的问题之一。
本研究拟建立AMI大鼠模型,运用超高效液相色谱-质谱法(ultra-high performance liquid chromatogra-phy-mass spectrometry,UPLC-MS)分析其尿液中代谢物的变化,筛选与AMI相关的差异代谢物,并探讨可能的分子机制,以期为AMI的法医学鉴定及其猝死机制研究提供新思路。
1 材料与方法
1.1 主要仪器与试剂
AU5800全自动生化分析仪(美国Beckman Coulter公司),HX-300S动物呼吸机(成都泰盟软件有限公司),BL-420S生物信号采集与分析系统(成都泰盟软件有限公司),2-16P台式低温离心机(美国Sigma公司),Lab-1A-80真空冷冻干燥机(北京博医康仪器有限公司),UltiMate 3000高效液相色谱仪(美国Thermo Fisher Scientific公司),ACQUITY UPLC HSS T3色谱柱(2.1 mm×100.0 mm,1.8 μm;美国Waters公司),Milli-DI®水纯化系统(德国Merck公司)。
维生素D3(美国Sigma公司),异氟烷(深圳市瑞沃德生命科技有限公司),多聚甲醛、乙醇、二甲苯(天津市科密欧化学试剂有限公司),甲醇、甲酸、乙腈(美国Sigma公司)。
1.2 动物模型制备
SPF级雄性SD大鼠(北京维通利华实验动物技术有限公司) 18只,体质量(200±20) g,6~8周龄,饲养于室内温度24~26 ℃、湿度40%~60%、12 h昼夜交替的房间。适应性喂养1周后,将18只大鼠随机分为3组,假手术组、AMI组、高脂血症+急性心肌梗死组(hyperlipidemia + acute myocardial infarction,HAMI)组,每组6只。本研究已获得山西医科大学科学研究伦理审查委员会的审批(审批文号2021LL244)。
假手术组:经普通标准饲料喂养12周后,使用AU5800全自动生化分析仪检测大鼠血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)。术前禁食禁水12 h,使用动物专用异氟烷(2%~3%)麻醉大鼠,使用夹子夹住大鼠尿道口处,将其固定在手术台上,经口气管插管并连接HX-300S动物呼吸机,通气频率70次/min,潮气量0.8~1 mL,呼吸比2∶1。四肢连接生物信号采集与分析系统记录术中心电图。于第3~4肋间切开心脏搏动最强处皮肤,钝性分离肌层组织,剥离心包暴露心脏,用6-0缝线在左心耳根部下方3~5 mm处穿过,但不结扎。探查无出血后关闭胸腔,挤出胸腔内空气,防止大鼠因气胸死亡,迅速将胸小肌和胸大肌复位,关胸。使用4-0缝线对皮肤切口处进行荷包缝合。将大鼠置于37 ℃恒温电热毯上,密切观察其状态。术后30 min脱颈椎处死大鼠。
AMI组:同假手术组方法,术中用6-0缝线在左心耳根部下方3~5 mm处连同少量心肌组织结扎冠状动脉左前降支诱发死亡。
1.3 检材提取与制备
大鼠死亡后,立即使用注射器于膀胱采集大鼠尿液,置于无菌微量离心管中,-80 ℃保存,用于代谢组学检测。再取大鼠完整心脏置于4%多聚甲醛溶液中固定,用于HE染色。
1.4 HE染色
将固定好的心肌组织进行梯度75%、85%、90%、95%、100%乙醇脱水,二甲苯透明、浸蜡、包埋,切片(厚度5 μm),粘片与烘片,并进行HE染色,镜下观察拍照。
1.5 代谢组学检测
1.5.1 样本前处理
提前将尿液样本梯度解冻,取200 μL尿液样本,加入200 μL甲醇,使用2-16P台式低温离心机以12 927×g离心15 min,收集上清液。将上清液置于Lab-1A-80真空冷冻干燥机中干燥后,用200 μL甲醇复溶,以12 927×g离心15 min,取上清液进行分析。所有待测尿液样本各取10 μL,混合制成质量控制(quality control,QC)样本。
1.5.2 仪器检测条件
使用UltiMate 3000高效液相色谱仪进行代谢组学检测。为减少在整个分析过程中可能产生的仪器系统误差,所有被检测的尿液样本随机排序进样。为观察是否存在样品组分残留、考察系统稳定性,先将QC样本连续进样5次后再进待测尿液样本。每进10个待测尿液样本后,将空白样本(纯乙腈溶液)和QC样本各进样1次。
色谱条件:采用ACQUITY UPLC HSS T3色谱柱,柱温40 ℃,流速0.2 mL/min,进样量5 μL。流动相A为0.1%的甲酸水溶液,流动相B为乙腈溶液;流动相梯度洗脱程序:0~2 min,2%B;2~3 min,2%B~35%B;3~17 min,35%B~70%B;17~18 min,70%B;18~29 min,70%B~98%B;29~31 min,98%B;31~33 min,98%B~2%B;33~35 min,2%B。
质谱条件:采用电喷雾离子源,喷雾电压正极为3.5 kV,负极为2.5 kV,质量扫描范围m/z 80~1 200。毛细管温度为320 ℃;加热器温度为300 ℃;鞘气流速35 arb,辅助气流速10 arb;分辨率设定为“MS Full Scan 35 000 FWHM”和“MS/MS 17 500 FWHM”,碰撞能量归一化设定为12.5、25和37.5 eV。
1.6 统计分析
大鼠血脂数据用
2 结 果
2.1 动物模型观察结果
2.1.1 大体观察
经高脂饮食喂养12周后的HAMI组大鼠体质量明显比AMI组和假手术组增加,毛色晦暗,倦卧懒动,主动进食量减少(表1)。经普通标准饲料喂养12周后,AMI组和假手术组大鼠毛色光滑柔顺,活泼好动,进食良好。HAMI组和AMI组大鼠结扎冠状动脉左前降支后观察到结扎部位以下心肌组织苍白,搏动明显减弱,结扎后均在20~30 min内发生死亡。
表1 大鼠的大体观察和血脂浓度变化
Tab. 1
| 组别 | 体质量/g | 主动进食量/ (g·d-1) | TC/ (mmol·L-1) | TG/ (mmol·L-1) | LDL/ (mmol·L-1) | HDL/ (mmol·L-1) | AI |
|---|---|---|---|---|---|---|---|
| 假手术 | 367.00±24.641) | 40.48±2.401) | 2.30±0.401) | 1.05±0.53 | 0.30±0.121) | 0.63±0.23 | 2.85±0.061) |
| AMI | 374.83±16.271) | 42.11±2.221) | 2.33±0.231) | 0.89±0.42 | 0.35±0.061) | 0.67±0.03 | 2.50±0.051) |
| HAMI | 442.17±36.59 | 20.12±2.11 | 4.00±0.96 | 1.07±0.76 | 1.33±0.44 | 0.64±0.15 | 5.29±1.18 |
2.1.2 大鼠血脂变化
与假手术组和AMI组相比,HAMI组的TC、LDL浓度均升高(表1)。假手术组和AMI组AI值较低,而HAMI组的AI值大于3.8(5.29±1.18,P<0.05),提示HAMI组大鼠发生冠状动脉粥样硬化。
2.1.3 大鼠心电图改变
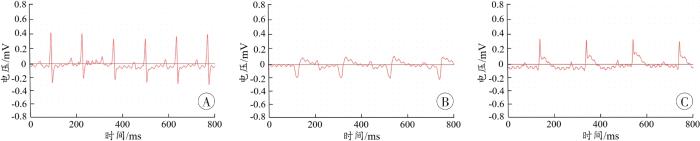
假手术组心电图节律平稳正常。AMI和HAMI组于冠状动脉左前降支结扎后5 min左右,均显示ST段抬高(图1),提示AMI和HAMI组发生急性心肌梗死。
图1
图1
各组大鼠的心电图
A:假手术组;B:AMI组;C:HAMI组。
Fig. 1
Electrocardiograms of rats in each group
2.1.4 大鼠心肌及冠状动脉组织学改变
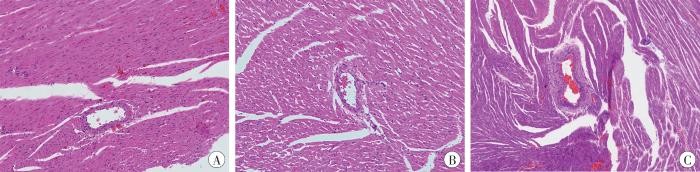
HE染色结果(图2)显示,假手术组冠状动脉和心肌组织未见异常。AMI组冠状动脉未见异常,心肌组织出现收缩带坏死。HAMI组大鼠冠状动脉内膜增厚,内皮细胞排列紊乱,内膜下有粥样物质沉积,血管周围有炎症细胞浸润,心肌收缩带坏死,肌质凝聚。
图2
图2
各组大鼠冠状动脉和心肌的组织病理学改变(HE×200)
A:假手术组;B:AMI组;C:HAMI组。
Fig. 2
Histopathological changes in the coronary artery and myocardium of rats in each group (HE×200)
2.2 尿液样本的代谢组学分析
2.2.1 数据质量控制
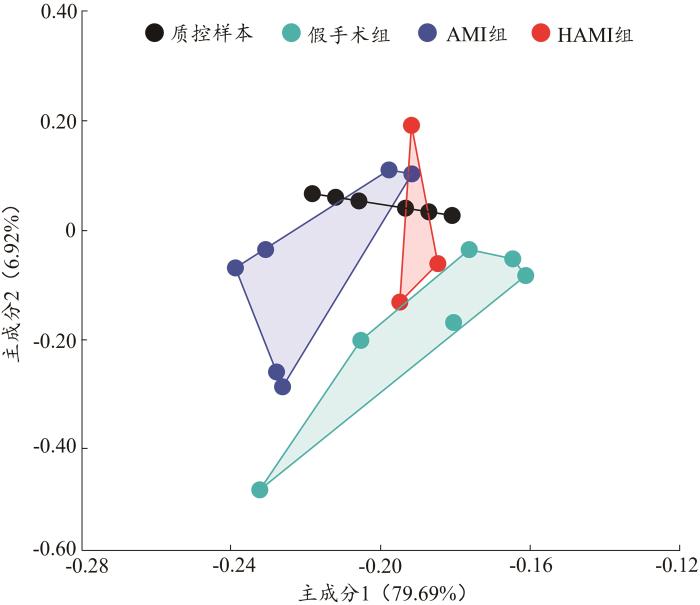
所有QC样本都紧密聚集在一起,在PCA中没有表现出明显的离散趋势,表明实验仪器及实验数据稳定性好,可进行后续分析(图3)。
图3
图3
各组大鼠尿液样本总体分布的PCA得分图
Fig. 3
PCA score plot of the overall distribution ofurine samples of rats in each group
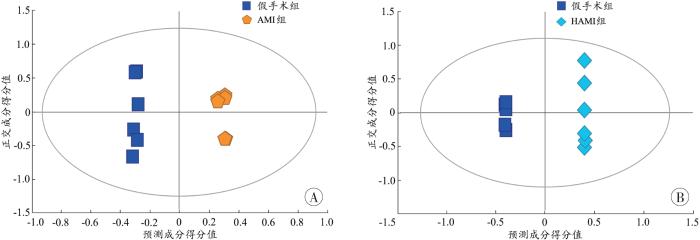
2.2.2 多元统计分析
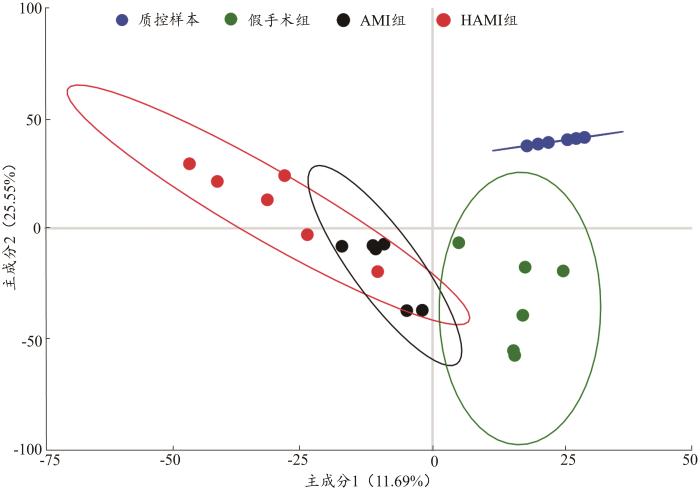
图4
图4
各组大鼠尿液样本总体分布的PLS-DA得分图
Fig. 4
PLS-DA score plot of the overall distribution ofurine samples of rats in each group
图5
图5
不同组别之间的OPLS-DA得分图
A:假手术组-AMI组;B:假手术组-HAMI组。
Fig. 5
Scatter plots of OPLS-DA scores between different groups
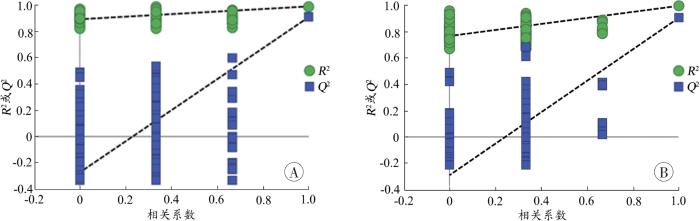
图6
图6
不同组别之间的OPLS-DA模型验证图
A:假手术组-AMI组;B:假手术组-HAMI组。
Fig. 6
Validation plots for OPLS-DA model between different groups
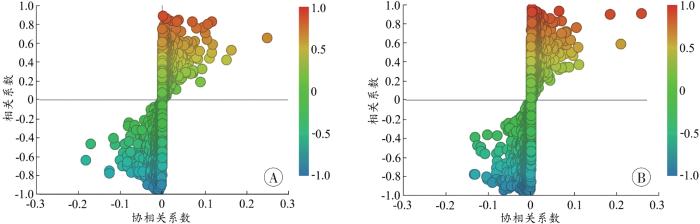
图7
图7
不同组别之间的S-plots图
A:假手术组-AMI组;B:假手术组-HAMI组。
Fig. 7
S-plots between different groups
2.2.3 尿液差异代谢物的筛选
表2 AMI和HAMI组VIP值排名前五的差异代谢物
Tab. 2
| 组别 | 排序 | 代谢物 | 代谢物中文名称 | CAS号 | VIP值 | P值 | 趋势 |
|---|---|---|---|---|---|---|---|
| AMI | 1 | 3-indoleacrylic acid | 3-吲哚丙烯酸 | 29953-71-7 | 7.290 | 0.048 | ↑ |
| 2 | L-ascorbic acid 2-sulfate | L-抗坏血酸2-硫酸盐 | 37627-95-5 | 6.590 | 0.010 | ↑ | |
| 3 | 4-guanidinobutyric acid | 4-胍基丁酸 | 463-00-3 | 4.360 | 0.022 | ↓ | |
| 4 | 2-hydroxyphenylalanine | 2-羟基苯丙氨酸 | 2370-61-8 | 4.130 | 0.046 | ↑ | |
| 5 | hypoxanthine | 次黄嘌呤 | 68-94-0 | 2.360 | 0.001 | ↑ | |
| HAMI | 1 | hippuric acid | 马尿酸 | 495-69-2 | 17.800 | <0.001 | ↑ |
| 2 | creatinine | 肌酐 | 60-27-5 | 12.740 | <0.001 | ↑ | |
| 3 | creatine | 肌酸 | 57-00-1 | 9.180 | 0.007 | ↓ | |
| 4 | D-(+)-malic acid | D-(+)-苹果酸 | 636-61-3 | 6.350 | 0.048 | ↑ | |
| 5 | genistein | 染料木黄酮 | 446-72-0 | 5.630 | 0.024 | ↑ |
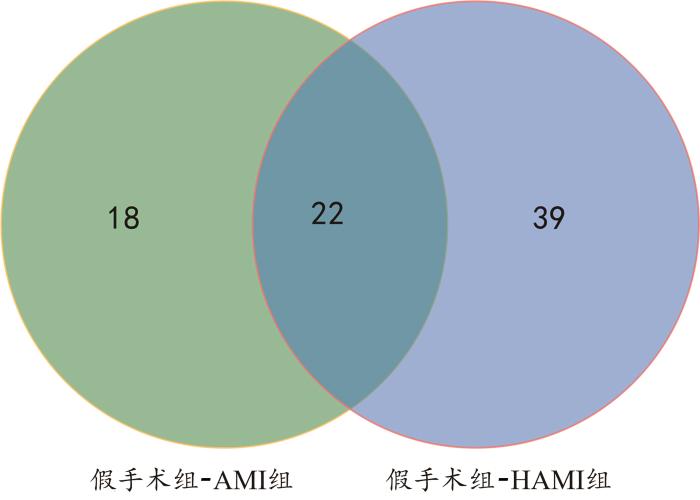
图8
图8
不同组别之间差异代谢物的韦恩图
Fig. 8
Venn diagram of differential metabolitesbetween different groups
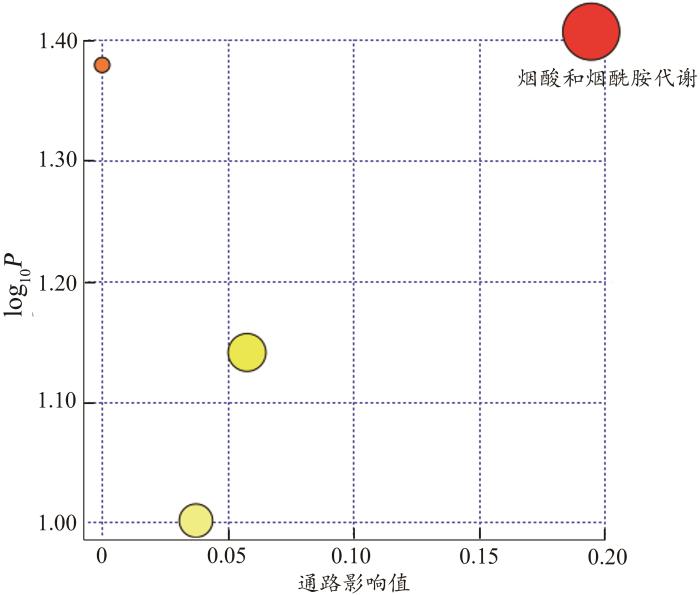
2.2.4 尿液差异代谢物的通路富集分析
通过MetaboAnalyst 6.0对AMI和HAMI组共同的22种差异代谢物进行代谢通路富集分析,主要涉及的代谢通路为烟酸和烟酰胺代谢(图9)。
图9
图9
AMI组-HAMI组共同差异代谢物的MetPA通路分析图
Fig. 9
MetPA pathway analysis diagram of commondifferential metabolites in the AMI-HAMI groups
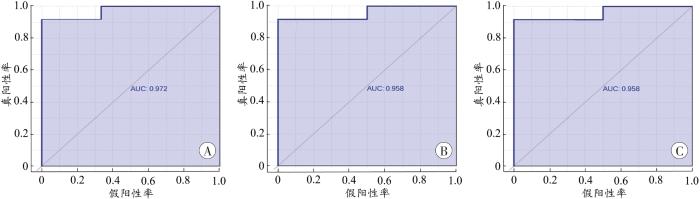
2.2.5 尿液差异代谢物的ROC分析
图10
图10
尿液差异代谢物的ROC曲线分析结果
A:N8-乙酰亚精胺;B:3-甲基组胺;C:胸腺嘧啶。
Fig. 10
Results of ROC curve analysis of differential metabolites in urine
表3 AMI组和HAMI组的共同代谢物
Tab. 3
| 排序 | 代谢物 | 代谢物中文名称 | CAS号 | AUC值 | P值 | 趋势 |
|---|---|---|---|---|---|---|
| 1 | N8-acetylspermidine | N8-乙酰亚精胺 | 13431-24-8 | 0.972 | <0.001 | ↓ |
| 2 | 3-methylhistamine | 3-甲基组胺 | 644-42-8 | 0.958 | <0.001 | ↓ |
| 3 | thymine | 胸腺嘧啶 | 65-71-4 | 0.958 | <0.001 | ↓ |
| 4 | maltol | 麦芽酚 | 118-71-8 | 0.931 | 0.002 | ↓ |
| 5 | 3-methylglutaric acid | 3-甲基戊二酸 | 626-51-7 | 0.917 | <0.001 | ↓ |
| 6 | kynurenic acid | 犬尿喹啉酸 | 492-27-3 | 0.889 | <0.001 | ↓ |
| 7 | pseudouridine | 伪尿苷 | 1445-07-4 | 0.889 | 0.004 | ↓ |
| 8 | trans-3-hexenoic acid | 反式-3-己烯酸 | 1577-18-0 | 0.889 | 0.003 | ↓ |
| 9 | xanthurenic acid | 黄尿酸 | 59-00-7 | 0.889 | <0.001 | ↓ |
| 10 | crotonic acid | 巴豆酸 | 107-93-7 | 0.875 | 0.008 | ↓ |
| 11 | N6-acetyl-L-lysine | N6-乙酰-L-赖氨酸 | 692-04-6 | 0.833 | 0.002 | ↓ |
| 12 | N-acetylserine | N-乙酰丝氨酸 | 16354-58-8 | 0.819 | 0.038 | ↑ |
| 13 | mesaconic acid | 甲基延胡索酸 | 498-24-8 | 0.806 | 0.008 | ↓ |
| 14 | nicotinamide | 烟酰胺 | 98-92-0 | 0.806 | 0.016 | ↓ |
| 15 | methylimidazoleacetic acid | 甲基咪唑乙酸 | 2625-49-2 | 0.792 | 0.008 | ↓ |
| 16 | trans-aconitic acid | 反式乌头酸 | 4023-65-8 | 0.778 | 0.014 | ↓ |
| 17 | dodecanedioic acid | 十二烷二酸 | 693-23-2 | 0.736 | 0.046 | ↓ |
| 18 | N-acetyl-L-cysteine | N-乙酰-L-半胱氨酸 | 616-91-1 | 0.722 | 0.020 | ↓ |
| 19 | 2-hydroxyhippuric acid | 2-羟基马尿酸 | 487-54-7 | 0.708 | 0.026 | ↓ |
| 20 | L-norleucine | L-正亮氨酸 | 327-57-1 | 0.625 | 0.366 | ↓ |
| 21 | valylproline | 缬氨酸 | 20488-27-1 | 0.625 | 0.324 | ↓ |
| 22 | ecgonine | 芽子碱 | 481-37-8 | 0.583 | 0.121 | ↓ |
3 讨 论
AMI最常见的病因是动脉粥样硬化[3],少数继发于非斑块性病因。虽然发病机制有所不同,但两种情况均会导致AMI,进而死亡。为了模拟法医学实践中人体AMI的病理生理状态,本研究基于课题组前期动物模型制备方法[9],构建了两种AMI大鼠模型,并以假手术组大鼠模型作为对照,排除手术过程中开胸暴露对代谢物的影响。AMI组大鼠模拟急性心肌梗死,正常饮食喂养12周后结扎冠状动脉。AMI组结扎冠状动脉左前降支后观察到冠状动脉供血区域的心肌苍白,实时心电图显示ST段抬高,提示心肌梗死的发生。HE染色结果提示,AMI组冠状动脉未见异常,心肌组织出现收缩带坏死,进一步验证了心肌梗死的发生。以上结果表明,本次AMI组模型制备成功。HAMI组模拟在高脂血症的基础上发生急性心肌梗死。HAMI组大鼠高脂饮食喂养12周后结扎冠状动脉。与假手术组相比,HAMI组大鼠的TC、LDL浓度升高,AI值升高,提示高脂血症的发生。HAMI组结扎冠状动脉左前降支后观察到冠状动脉供血区域的心肌苍白,实时心电图显示ST段抬高,提示心肌梗死的发生。HE染色结果提示,HAMI组大鼠冠状动脉内膜增厚,内皮细胞排列紊乱,管腔狭窄,心肌组织出现收缩带坏死,进一步证实了高脂血症和心肌梗死的形成。以上结果表明,本研究HAMI模型制备成功,但高脂血症模型冠状动脉粥样硬化的改变不够典型,还需进一步的改进。
相较于传统的血液检测,尿液检测采集过程简单且无创,样本量大,可满足各种检测的要求;尿液组分相对单一,检测难度较低;最重要的是,尿液中没有稳态调控机制,可以更早、更灵敏地反映人体异常变化,对于生物标志物的研究来说是非常有利的。因此,本研究采用UPLC-MS技术对AMI大鼠模型尿液中的小分子代谢物进行检测。
3.1 AMI和HAMI的差异代谢物
3.2 AMI和HAMI的共同代谢物
AMI和HAMI组模拟了法医学实践中发生AMI的两种情况。本研究利用两组共同的差异代谢物进行分析,能够更加精准地筛选出AMI潜在的特异生物标志物。因此,对AMI和HAMI组共同的22个差异代谢物进行单变量ROC曲线分析,发现N8-乙酰亚精胺、3-甲基组胺和胸腺嘧啶的AUC值大于0.95,有望成为诊断AMI的潜在生物标志物。
多胺,包括亚精胺及其衍生物,是一种脂肪分子,可通过调节心肌细胞凋亡和自噬来调节心肌缺血应激反应[12]。临床研究也已经确定了多胺在缺血级联反应期间心肌细胞死亡中的关键调节作用[13]。此外,多胺消耗已被证明可以保护心肌细胞免受缺血诱导的凋亡[14]。细胞内亚精胺由亚精胺N8-乙酰转移酶分解为N8-乙酰亚精胺,然后从细胞中排泄出来,因此N8-乙酰亚精胺是细胞内多胺活性的血浆指示器[15]。NAYAK等[16]提出N8-乙酰亚精胺参与心肌细胞死亡的调节,并在缺血性损伤中导致心脏功能不全,是一种潜在的缺血性心肌病的生物标志物。本研究发现,在AMI和HAMI组中N8-乙酰亚精胺均有所降低,与上述研究结果一致,证明了N8-乙酰亚精胺在AMI中发挥着关键性的作用,可能与其调节心肌细胞凋亡和自噬有关。3-甲基组胺是组胺的一种代谢物。LIU等[17]通过分析心肌梗死大鼠模型组织的代谢差异物,发现22种代谢物(包含3-甲基组胺)可作为心肌梗死的潜在生物标志物。COSTINITI等[18]发现N1-甲基组胺是一种重要的心脏底物,能为线粒体酶单胺氧化酶提供燃料并引发活性氧产生,参与心脏损伤,这表明甲基组胺在AMI中起到重要的作用。本研究结果与上述研究一致,表明3-甲基组胺有望成为诊断AMI的潜在生物标志物。但其与AMI的具体关系和机制尚未阐明,需要进一步研究。胸腺嘧啶是一种嘧啶碱基,2-氨基异丁酸是嘧啶代谢的最终产物。已有研究[19]发现7种代谢物(包含胸腺嘧啶、2-氨基异丁酸)与心血管疾病显著相关。JIANG等[20]使用反相液相色谱-四极杆飞行时间质谱在AMI大鼠模型血清中鉴定出14个潜在的生物标志物,包含5-甲基胞嘧啶和胸苷,均可代谢为胸腺嘧啶。ZHAO等[21]使用基于液相色谱-四极杆飞行时间质谱的代谢组学方法检测出冠心病患者的差异代谢产物主要涉及的代谢通路有嘧啶代谢。本研究发现胸腺嘧啶在AMI组中有所降低,结合上述研究证明,胸腺嘧啶的改变可提示AMI的发生。尽管AMI患者的尿液、血液[20-21]与组织[4,17]的代谢组学分析结果存在差异,这可能归因于样本来源、采集方法、处理过程及分析方法的差异,但在血液和组织代谢组学分析中,均检出上述3种代谢物,与本研究结果一致。综上所述,N8-乙酰亚精胺、3-甲基组胺和胸腺嘧啶有望成为诊断AMI的潜在生物标志物。
综上所述,本研究应用非靶向代谢物组学分析获得了与AMI有关的22种差异代谢物及其代谢通路(烟酸和烟酰胺代谢),并通过ROC曲线筛选出诊断价值最高的3种代谢物——N8-乙酰亚精胺、3-甲基组胺和胸腺嘧啶。本研究结果表明,非靶向代谢组学方法有望用于AMI研究,N8-乙酰亚精胺、3-甲基组胺和胸腺嘧啶是AMI的潜在诊断指标。今后,我们将密切关注血液样本与心肌组织中的代谢变化,以及其与尿液代谢物的差异;同时扩大样本量,并采用人群样本进行验证,以进一步提高该方法在法医学实践中的应用潜力。
参考文献
Global burden of cardiovascular diseases and risk factors, 1990-2019: Update from the GBD 2019 study
[J].
急性心肌梗死的流行病学研究进展
[J].
Epidemiological research progress of acute myocardial infarction
[J].
Acute myocardial infarction in young individuals
[J].
Acute myocardial infarction: Etiologies and mimickers in young patients
[J].
123
.
Metabolomics in the opening decade of the 21st century: Building the roads to individualized health
[J].
Forensic identification of sudden cardiac death: A new approach combining metabolomics and machine learning
[J].
The use of gas chromatography coupled with high-resolution mass spectrometry-based untargeted metabolomics to discover metabolic changes and help in the determination of complex causes of death: A preliminary study
[J].
0c05178
.
芝麻素对冠心病大鼠脂代谢、血管内皮功能损伤及VCAM-1水平的影响
[J].
Effects of sesamin on lipid metabolism, vascular endothelial function damage and VCAM-1 level in rats with coronary heart disease
[J].
基于大鼠心肌组织mRNA表达谱筛选冠状动脉性猝死相关生物标志物
[J].
Screening biomarkers of sudden coronary death based on mRNA expression profile of rat myocardial tissues
[J].
冠心病不稳定心绞痛血瘀证患者尿液代谢组学特征的研究
[J].
Charac-teristics of urine metabonomics in patients with blood stasis syndrome of CHD unstable angina
[J].
遗传调控代谢物对冠心病不良预后的影响及其代谢紊乱的表观遗传标记研究
[D].
Impact of genetically influenced metabolites on adverse prognosis of coronary artery disease and epigenetic signatures of their metabolic disorders
[D].
Correlation between endogenous polyamines in human cardiac tissues and clinical parameters in patients with heart failure
[J].
Cardioprotection and lifespan extension by the natural polyamine spermidine
[J].
Involvement of polyamines in apoptosis of cardiac myoblasts in a model of simulated ischemia
[J].
Catabolism of polyamines
[J].
N8-acetylspermidine: A polyamine biomarker in ischemic cardiomyopathy with reduced ejection fraction
[J].
The metabolic disturbances of isoproterenol induced myocardial infarction in rats based on a tissue targeted metabonomics
[J].
Monoamine oxidase-dependent histamine catabolism accounts for post-ischemic cardiac redox imbalance and injury
[J].
Identification of metabolites associated with onset of CAD in diabetic patients using CE-MS analysis: A pilot study
[J].
Biomarkers in the early period of acute myocardial infarction in rat serum and protective effects of Shexiang Baoxin Pill using a metabolomic method
[J].
A metabonomics profiling study on phlegm syndrome and blood-stasis syndrome in coronary heart disease patients using liquid chromatography/quadrupole time-of-flight mass spectrometry
[J].
Differences in metabolism of time-release and unmodified nicotinic acid: Explanation of the differences in hypolipidemic action?
[J].
Nicotinic acid: Current status in lipid management and cardiovascular disease prevention
[J].
Nicotinic acid receptor agonists impair myocardial contractility by energy starvation
[J].
Niacin protects the isolated heart from ischemia-reperfusion injury
[J].